-
《环境研究通讯》刊文称:全世界每年因空气污染而死亡的人数约为210万。原因是大气中可吸入颗粒物(PM 2.5)浓度上升导致呼吸系统疾病。下列关于PM 2.5的说法不正确的是
A.PM 2.5是指大气中直径小于或等于2.5 um(10-6 m)的颗粒物,因此均能形成胶体
B.研制开发燃料电池汽车,降低机动车尾气排放,可以减少PM 2.5污染
C.PM 2.5专用口罩中使用了活性炭,是利用了活性炭的吸附性
D.工厂利用胶体电泳性质采用静电除尘工艺,可部分降低细颗粒物造成的污染
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是
A.密封保存的46 g NO2气体含有的分子数为NA
B.0.1 mol/L 碳酸钠溶液中阴离子总数大于0.1 NA
C.标准状况下,22.4 L HF中含有的氟原子数目为NA
D.常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.2 NA
难度: 中等查看答案及解析
-
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)
MgO(s)+CO2(g)+SO2(g) ΔH>0
该反应在恒容密闭容器中达到平衡后,若仅改变图中横坐标x的值,纵坐标y随x变化趋势合理的是

选项 x y
A 反应时间 CO2与CO的物质的量之比
B 反应温度 逆反应速率
C 体系压强 平衡常数K
D MgSO4的品质 CO的转化率
难度: 中等查看答案及解析
-
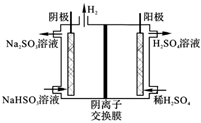
甲醇燃料电池工作原理如图,下列说法不正确的是

A.盐桥中的K+向负极移动
B.负极电极反应方程式为:CH3OH-6e-+8OH-=CO32-+6H2O
C.每消耗1 mol 甲醇,需消耗33.6 L 标况下的氧气
D.正极烧杯中溶液pH增大
难度: 中等查看答案及解析
-
下列操作对应的现象及解释正确的是
编号 操 作 现 象 解 释
A FeI2溶液中滴加过量氯水 溶液变黄 氯水氧化I-成碘单质,碘水呈黄色:
2I-+Cl2=I2+2Cl-
B 苯酚钠溶液中通入少量CO2 出现白色浑浊 苯酚酸性弱于碳酸,反应生成苯酚:
2C6H5O-+CO2+H2O=2C6H5OH+CO32-
C Ca(HCO3)2溶液中滴加过量NaOH溶液 出现白色沉淀 Ca2++HCO3-+OH-=CaCO3↓+H2O
D 含有等浓度的Mg2+和Cu2+的废水液中逐滴加入少量NaOH溶液调节溶液pH=7 溶液中先出现蓝色沉淀 Ksp[Cu(OH)2]< Ksp[Mg(OH)2],因此Cu2+先沉淀;Cu2++2OH-=Cu(OH)2↓
难度: 中等查看答案及解析
-
下列浓度关系正确的是
A.0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+)
B.0.1 mol/L的KOH溶液中通入标准状况下的CO2气体3.36 L,所得溶液中:c (K+)+c (H+)=c (CO32-)+c (HCO3-)+c (OH-)
C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (HCN)>c (Na+)>c (CN-)>c (OH-)>c (H+)
D.pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3)
难度: 困难查看答案及解析
-
把一定质量的铁完全溶解于某浓度的硝酸中收集到0.3 mol NO2和0.2 mol NO。向反应后的溶液中加入足量NaOH溶液充分反应,经过滤、洗涤后,把所得沉淀加热至质量不再减少为止。得到固体质量不可能为
A.18 g B.24 g C.30 g D.36 g
难度: 中等查看答案及解析

 ;
;