-
材料与人类生活密切相关,下列物品中最难降解的是
A. 真丝围巾 B. 宣纸 C. PVC塑料卡片 D. 淀粉做的餐具
难度: 简单查看答案及解析
-
设阿伏加德罗常数的值为NA。下列说法不正确的是
A. 在标准状况下,11.2LC3H8中共价键数目为5NA
B. 1molN2和3molH2充分反应后,容器中分子总数大于2NA
C. 18gOH-和 20g-OH 所 含 电子数目相同
D. 氯气通入到FeI2溶液中,当有3NAFe2+被氧化时,消耗标准状况下氯气33 6L
难度: 中等查看答案及解析
-
化合物X 的结构简式为
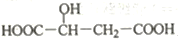 ,下列说法正确的是
,下列说法正确的是A. X为乙酸的同系物
B. X 中能发生酯化反应的官能团有3种
C.
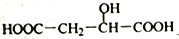 与X互为同分异构体
与X互为同分异构体D. 1molX与足量金属Na反应生成1.5molH2
难度: 中等查看答案及解析
-
下列实验操作或现象正确且能达到实验目的的是
实验目的
实验操作或现象
A
证明AgI 的Ksp小于AgCl 的Ksp
向两份相同的银氨溶液中分别滴加2滴等浓度的NaCl和NaI溶液,一份中产生黄色沉淀,另一份无明显现象
B
除去CO2中少量的SO2
将混合气体通过饱和Na2CO3溶液
C
证明溶液中含有Fe2+
向某溶液中先滴加氯水,再滴加少量KSCN溶液,溶液变成血红色
D
清洗用KMnO4 制备O2的试管中残留的MnO2
用稀盐酸清洗并用酒精灯加热试管
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
镁、锌等金属与H2O2 可形成“金属-H2O2”电池,能为潜水器提供动力,可用食盐水作为电解质溶液,如下图所示。下列有关Zn-H2O2电池的说法正确的是

A. 电流从Zn 电极沿导线流向Pt 电极
B. Pt为正极,电极反应为: H2O2+2e-=2OH-
C. 每消耗6.5gZn,将反应0.05mol H2O2
D. 食盐水中Cl-向Pt 电极移动
难度: 中等查看答案及解析
-
V、W、X、Y、Z五种短周期主族元素,原子序数依次增大,X的最外层电子数是内层电子数的三倍,W的气态氢化物和最高价氧化物对应的水化物反应生成一种盐,Y是同周期中原子半径最大的元素,Z的原子序数等于V、W、X的原子序数之和。下列说法错误的是
A. 简单离子的半径: W>Y
B. V、X可形成原子个数比为1:1、2:1的化合物
C. 简单气态氢化物的热稳定性X<W
D. X、Z同主族,Y、Z同周期
难度: 中等查看答案及解析
-
常温下,向20mL0.10mol/L的Na2CO3溶液中逐滴加入0.10mol/L 的盐酸,溶液pH的变化曲线如图所示。下列说法不正确的是
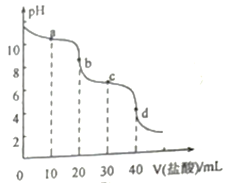
A. a点溶液中:c(HCO3-)>c(CO32-)
B. b点溶液中:c(H+)-c(OH-)= c(CO32-)- c(HCO3-)
C. c点溶液中: 3c(Na+)=4c(Cl-)
D. d点溶液中: c(Na+)+ c(H+)= 2c(CO32-)+ c(HCO3-)+ c(OH-)+ c(Cl-)
难度: 困难查看答案及解析

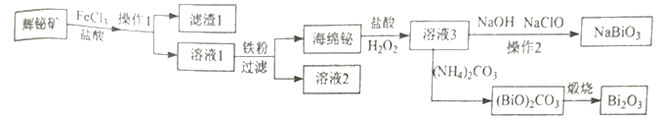
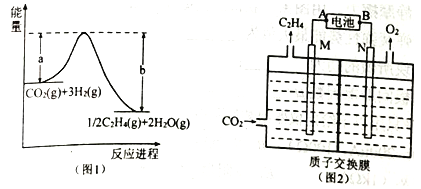

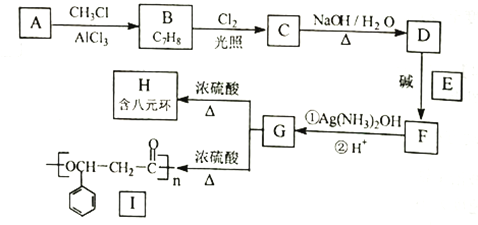
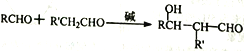

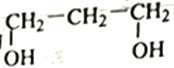 的合成路线。____________
的合成路线。____________