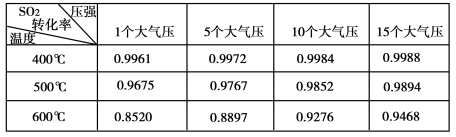
-
化学与生产、生活、社会密切相关。下列有关说法中,错误的是
A.服用铬含量超标的药用胶囊会对人体健康造成危害
B.镀层破坏后,镀锡铁板比镀锌铁板更耐腐蚀
C.关闭高能耗的化工企业,体现了“低碳经济”的宗旨
D.雾霾主要是由化石燃料燃烧排放的二氧化硫、氮氧化物、烟尘以及机动车尾气、建筑扬尘等导致的
难度: 简单查看答案及解析
-
下列叙述正确的是
A.常温下,反应C(s) + CO2(g)=2CO(g)不能自发进行,则该反应△H>0
B.强电解溶液的导电能力一定强于弱电解质溶液的导电能力
C.CH3COOH、Cu(OH)2、BaSO4、NH3都是常见的弱电解质
D.常温下就能发生的化学反应一定是放热反应
难度: 简单查看答案及解析
-
下列实验中所选用的仪器或操作合理的是
A.用紫色石蕊试液作指示剂测定NaOH溶液的物质的量浓度
B.用湿润pH试纸测定某H2SO4溶液的pH
C.用酸式滴定管量取25.00 mL高锰酸钾溶液
D.中和滴定实验时,用待测液润洗锥形瓶
难度: 简单查看答案及解析
-
向水中分别加入下列溶液,对水的电离平衡不产生影响的是
A.KHSO4溶液 B.KHCO3溶液
C.KHS溶液 D.KI溶液
难度: 简单查看答案及解析
-
下列有关溶液pH变化的判断中,正确的是
A.加热盐酸溶液,溶液的pH减小
B.随温度的升高,纯水的pH增大
C.新制氯水经光照一段时间后,pH减小
D.氢氧化钠溶液久置于空气中,pH增大
难度: 简单查看答案及解析
-
在体积为1L的密闭容器中发生反应2SO2(g)+O2(g)
2SO3(g)。达到平衡后,若采用下列措施一段时间后,能增大逆反应速率的是
A.体积不变,通入NO
B.增大容器容积
C.体积不变,通入大量O2
D.降低体系温度
难度: 简单查看答案及解析
-
常温下,下列各组离子在有一定关限定条件下的溶液中一定能大量共存的是
A.由水电离产生的c(H+)=10-12 mol·L一1的溶液中:K+、Na+、Fe2+、NO3-
B.常温下,pH=7的溶液中: Al3+、Cl-、
、SO42-
C.常温下,
=1×10-12的溶液:K+、Cu2+、S2-、Cl-
D.pH=13的溶液中:K+、Ba2+ 、Cl-、OH-
难度: 中等查看答案及解析
-
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是
A.某温度下,测得溶液的pH < 7
B.溶液中c(Na+)=c(A2-)
C.溶液中存在Na+、HA- 、 A2-、 H2A 多种微粒
D.NaHA溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
难度: 中等查看答案及解析
-
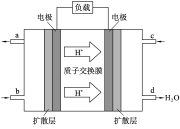
下图有关电化学的示意图正确的是

难度: 简单查看答案及解析
-
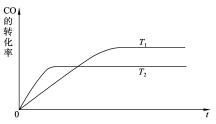
对于可逆反应:mA(g)+nB(g)
xC(g)+ yD(s) ΔH=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如下图所示,下列判断正确的是

A.ΔH>0,m+n>x+y B.ΔH<0,m+n>x+y
C.ΔH<0,m+n>x D.ΔH>0,m+n<x
难度: 中等查看答案及解析
-
已知反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如图所示原电池。下列说法中正确的是
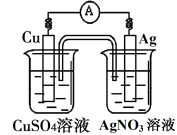
A.铜电极是正极,其电极反应为Cu-2e-=Cu2+
B.银电极上发生还原反应,电极质量增加
C.当铜电极质量减少0.64g时,电解质溶液中有0.02mol电子通过
D.外电路中电子由银电极流向铜电极
难度: 中等查看答案及解析
-
化学兴趣小组的同学用如图实验装置电解硫酸铜溶液,a、b为惰性电极。则下列说法错误的是
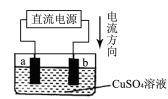
A.a是电解池的阴极、b是电解池的阳极
B.b电极上的电极反应为:4OH--4e-=2H2O + O2↑
C.通电一段时间后,溶液的PH减小
D.通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的CuSO4
难度: 中等查看答案及解析
-
某温度下,在一定体积的密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度
如下表,下列说法错误的是
物质
X
Y
Z
W
初始浓度/mol·L-1
0.5
0.6
0
0
平衡浓度/mol·L-1
0.1
0.1
0.4
0.6
A.增大压强反应的平衡常数不变,但X的转化率增大
B.该反应的化学方程式为:4X (g)+5Y (g)
4Z (g)+ 6W (g)
C.反应达到平衡时,X的转化率为80%
D.其它条件不变,若增大Y的起始浓度,X的转化率增大
难度: 中等查看答案及解析
-
下列事实或操作与盐类水解无关的是
A.配制FeC13溶液时,要滴加少量的盐酸
B.加热蒸干并灼烧Na2SO3溶液,得到Na2SO4固体
C.明矾净水
D.氨态氮肥(含NH4+)不能与草木灰混合使用
难度: 中等查看答案及解析
-
25℃时,浓度均为0.1 mol·L-1的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是
A.在0.1 mol·L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(B+)
B.若将0.1 mol·L-1 BOH溶液稀释至0.001 mol·L-1则溶液的pH=9
C.若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+)
D.若将上述两溶液按体积比1∶1混合,则混合液中:c(A-)>c(B+)>c(H+)>c(OH-)
难度: 中等查看答案及解析