-
元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期.下列有关推测正确的是( )
A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO
C.NH4HSO3溶液与足量NaOH溶液反应:NH4++OH-=NH3↑+H2O
D.将1mol/LNaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+难度: 中等查看答案及解析
-
对于苯乙烯(结构如图)的下列叙述中:①能使酸性KMnO4溶液褪色;②可发生加聚反应;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面,其中正确的是( )
A.仅①②④⑤
B.仅①②⑤⑥
C.仅①②④⑤⑥
D.全部正确难度: 中等查看答案及解析
-
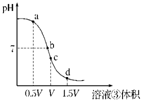
已知PbI2的Ksp=7.0×10-9,将7.5×10-3 mol/L的KI与Pb(NO3)2溶液按体积比为2:1混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度(mol/L)为( )
A.8.4×10-4
B.5.6×10-4
C.4.2×10-4
D.2.8×10-4难度: 中等查看答案及解析
-
某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如图所示的装置进行实验,过一段时间后观察.下列现象不 可能出现的是( )

A.B中导气管产生气泡
B.B中导气管里形成一段水柱
C.金属片剪口变红
D.锌被腐蚀难度: 中等查看答案及解析
-
下列变化中,属于物理变化的是( )
①石油的分馏 ②煤的干馏 ③石油的裂化 ④铝热反应 ⑤由乙烯变为聚乙烯 ⑥氧气转变为臭氧 ⑦乙烯催熟果实 ⑧苯遇溴水 ⑨海水蒸馏法制取淡水.
A.①②③④
B.①②⑤⑦
C.①⑧⑨
D.①②⑥⑨难度: 中等查看答案及解析
-
有人认为CH2=CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br-,然后Br+首先与CH2=CH一端碳原子结合,第二步才是Br-与另一端碳原子结合.根据该观点如果让CH2=CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是( )
A.BrCH2CH2Br
B.ClCH2CH2Cl
C.BrCH2CH2I
D.BrCH2CH2Cl难度: 中等查看答案及解析
-
甲苯与足量的氢气加成后的产物一氯取代物的同分异构体数目为( )
A.3
B.4
C.5
D.6难度: 中等查看答案及解析
-
无放射性的同位素称为“稳定同位素”,在陆地生态系统研究中2H、13C、15N、18O、34S等常用作环境分析指示物.下列有关“稳定同位素”的说法正确的是( )
A.34S原子核内中子数为16
B.2H+的酸性比1H+的酸性更强
C.13C与15N原子核内的质子数相差2
D.16O与18O的化学性质相同难度: 中等查看答案及解析
-
某密闭容器中充入一定量SO2、O2,发生反应2SO2+O2⇌2SO3,测得SO3浓度与反应温度关系如图.下列说法正确的是( )
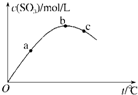
A.该反应△H>0
B.SO2转化率:a>b>c
C.化学反应速率:c>b>a
D.平衡常数K:b>c>a难度: 中等查看答案及解析
-
下列所选用试剂(仪器自选)能达到实验目的是( )
A.探究同周期非金属元素性质递变规律:氯水、溴化钾、碘化钾、四氯化碳
B.探究+4价硫既有氧化性又有还原性:亚硫酸钠溶液、溴水、酸性高锰酸钾溶液、盐酸
C.探究SO2和Cl2漂白原理不同:含酚酞的氢氧化钠溶液
D.探究氨气具有还原性:碳酸氢铵、碱石灰、氧化铜、无水硫酸铜难度: 中等查看答案及解析
-
已知:NA表示阿伏伽德罗常数的数值,则下列说法正确的是( )
A.7.8 g Na2O2中所含阴离子的数目是0.2NA
B.标准状况下,2.24 L 18O2中所含中子的数目是2NA
C.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1mol/L
D.用足量NaOH溶液完全吸收1 mol Cl2时,转移电子的数目是2NA难度: 中等查看答案及解析
-
在容积均为500mL的Ⅰ、Ⅱ、Ⅲ三个密闭容器中分别充入1mol N2和2.5mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下发生反应N2+3H2⇌2NH3(△H<0).实验测得反应均进行到t min 时N2的体积分数如图所示.下列说法正确的是( )

A.当v(H2)=3v(N2)时,三个容器中的反应达平衡状态
B.在t min时,一定达化学平衡状态的是Ⅱ
C.在t min时,一定达化学平衡状态的是Ⅲ
D.三个容器中的反应均达到平衡后,容器Ⅰ中混合气体的平均相对分子质量最小难度: 中等查看答案及解析
-
下列有关热化学方程式的评价合理的是( )
实验事实 热化学方程式 评价 A 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,将稀硫酸与 稀氢氧化钡溶液混合 H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)
△H=-114.6 kJ•mol-1
正确B 稀醋酸与稀氢氧化钠溶液混合 CH3COOH(aq)+NaOH(aq)=NaCl(aq)+H2O(l)
△H=-57.3k J•mol-1不正确;因为醋酸状态为“l”,而不是“aq”. C 160 g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ SO3(g)+H2O(l)=H2SO4(aq)△H=-130.3 kJ•mol-1 不正确;因为反应热为△H=-260.6 kJ•mol-1 D 已知25℃、101 kPa下,120g石墨完全燃烧放出热量3935.1 kJ C(s)+O2(g)=CO2(g)
△H=-393.51 kJ•mol-1不正确;同素异形体要注名称:C(石墨,S)
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
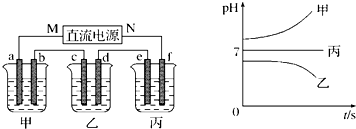
如图为一电化学综合实验装置.其中装置D为用加有酚酞的淀粉碘化钾溶液润湿的长条滤纸,c、d为铂片.整套装置工作一段时间后,发现铂片d的周围变为蓝色.下列有关说法错误的是( )

A.铂片c上发生的反应为2H++2e-══H2↑,c周围变为红色
B.装置C中,b电极周围的颜色变深
C.Z单质的金属活动性较Cu强
D.装置A、B之间倒置的U形管,是沟通两装置的离子通道难度: 中等查看答案及解析
-
下列各组变化中,化学反应的热量变化(△H或Q)前者小于后者的一组是( )
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1;CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
②2H2(g)+O2(g)═2H2O(l)△H1;H2(g)+O2(g)═H2O(l)△H2
③t℃时,在一定条件下,将1mol SO2和1mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别
为Q1、Q2
④CaCO3(s)═CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)═Ca(OH)2(s)△H2.
A.①②③
B.②④
C.②③④
D.③④难度: 中等查看答案及解析
-
按如图所示装置进行下列不同的操作,其中不正确的是( )
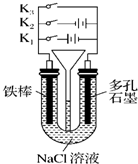
A.铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2
B.只接通K1,一段时间后,U形管中出现白色沉淀
C.只接通K2,U形管左、右两端液面均下降
D.先只接通K1,一段时间后,漏斗液面上升,然后再只接通K2,漏斗液面下降难度: 中等查看答案及解析
-
如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器内各自发生下列反应:X(g)+Y(g)⇌2Z(g)+W(g);△H>0,达到平衡时,VA=1.2a L.则下列说法不正确的是( )
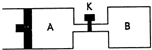
A.反应开始时,B容器中化学反应速率快
B.平衡时,A容器中X的转化率为40%,且比B容器内X的转化率大
C.打开K一段时间再次达到平衡时,A的体积为1.6aL(连通管内体积不计)
D.打开K再次达到平衡后,升高温度,A容器体积会增大难度: 中等查看答案及解析
-
已知镍氢电池的某极是储氢合金X(合金X结合氢气的形式可表示为XH6),另一电极为NiOOH/Ni(OH)2,其总反应式为:
XH6+6NiOOHX+6Ni(OH)2.下列说法正确的是( )
A.充电时电源的正极与电池的X极相连
B.放电时负极电极反应式为:XH6+6e-═X+6H+
C.充电时阳极电极反应式为:6Ni(OH)2+6OH--6e-═6NiOOH+6H2O
D.电池放电时反应了1 mol XH6,若用于电解水,理论上可得到16 g氧气难度: 中等查看答案及解析
-
反应N2O4(g)⇌2NO2(g);△H=+57kJ•mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.若P2>P1,则化学平衡常数KA>KC难度: 中等查看答案及解析