-
一些不法分子受利益驱动,非法从下水道和泔水中提取“地沟油”,并作为食用油低价销售给一些小餐馆。“地沟油”,是一种质量极差、极不卫生的非食用油,它含有毒素,流向江河会造成水体营养化,一旦食用,会破坏白血球和消化道黏膜,引起食物中毒,甚至致癌。下列说法不正确的是:
A、油脂是高级脂肪酸与甘油形成的酯类化合物
B、通过油脂的碱性水解来制肥皂
C、牛油可以使溴水褪色,也可以与氢气发生加成反应
D、地沟油经过一系列加工后,可以转化为生物柴油用作发动机燃料
难度: 简单查看答案及解析
-
在短周期中的X和Y两种元素可组成化合物XY3,说法正确的是:
A、X和Y一定不属于同一主族
B、X和Y可属于同一周期,也可属于两个不同周期
C、若Y的原子序数为m,X的原子序数不可能是m±4
D、XY3一定是离子化合物
难度: 简单查看答案及解析
-
下列离子方程式的书写正确的是
A、等物质的量浓度、等体积的Ca(HCO3)2溶液与氢氧化钠溶液相混合:
Ca2++2HCO3-+2OH-
CaCO3↓+CO32-+2H2O
B、苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O=C6H5OH+HCO3-
C、亚硫酸钠的水解; SO32- + 2H2O
H2SO3 + 2OH-
D、在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:
3Fe2++4H++NO3-
3Fe3++NO↑+2H2O
难度: 简单查看答案及解析
-
下列混合溶液中,各离子浓度的大小顺序不正确的是:
A、10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:
B、10mL1mol/LNH4Cl溶液与5mL2mol/LNaOH溶液混合:
C、
溶液与
溶液混合:
D、将pH=3的盐酸与pH=11的氨水等体积混合后:
c(NH4+)>c(Cl—)>c(OH-)>c(H+)
难度: 简单查看答案及解析
-
下列变化的实质相似的是
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
②二氧化硫和氯气均能使品红溶液褪色
③二氧化硫能使品红溶液、溴水褪色
④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸用铁的容器存放、加热条件下浓硫酸能与木炭反应
⑥浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
A、只有②③④ B、只有⑤ C、只有③④⑥ D、全部
难度: 简单查看答案及解析
-
一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应:
2X(g)+Y(g)
2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是: A、将容器体积变为10L,Z的平衡浓度变为原来的
B、在该温度下,该反应的平衡常数K=0.011
C、达到平衡时,容器内气体的压强是原来的90%
D、若降低温度,X的体积分数增大,则该反应的△H<0
难度: 简单查看答案及解析
-
下列说法正确的是:
A、实验室里需要480mL 2.0mol·L-1的氢氧化钠溶液,配制溶液时先称量氢氧化钠固体38.4克,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作
B、用标准盐酸滴定NaOH溶液测其浓度时,酸式滴定管用蒸馏水洗涤后,没用标准盐酸润洗,直接装标准盐酸滴定,所测的碱液浓度偏低
C、蒸发硫酸铜溶液时蒸发皿放在石棉网上加热,并用坩埚钳夹取蒸发皿
D、向氢氧化铁胶体中逐滴加入稀硫酸,先出现红褐色沉淀,继续滴加硫酸,沉淀溶解得到黄色溶液
难度: 简单查看答案及解析
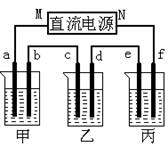
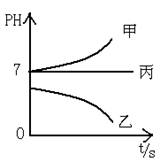


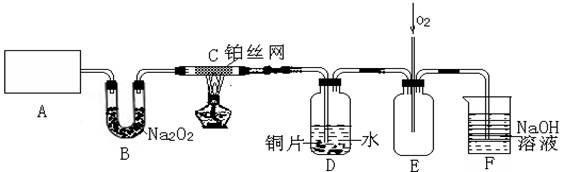 (3)D中铜片发生反应的离子方程式为___________________________,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的___________(填下列各项序号)
(3)D中铜片发生反应的离子方程式为___________________________,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的___________(填下列各项序号)