-
下列有关金属腐蚀与防护的说法正确的是( )
A.纯银器表面在空气中会因化学腐蚀渐渐变暗
B.地下输油钢管与外加直流电源的正极相连可保护其不受腐蚀
C.海轮外壳连接锌块是采用牺牲阴极的阳极保护法保护外壳不受腐蚀
D.当镀锡铁制品的镀层破损时,锡镀层仍能对铁制品起保护作用
难度: 中等查看答案及解析
-
常温下,下列离子能使纯水中的H+离子数目增加的是 ( )
A.S2- B.CO32- C.NH4+ D.Br-
难度: 中等查看答案及解析
-
有关常温下pH均为3的醋酸和硫酸的说法正确的是( )
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11mol/L
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
难度: 中等查看答案及解析
-
设NA代表,下列说法正确的是( )
常温常压下,氧气和臭氧的混合物16g中约含有NA个氧原子
B.标准状况下,11.2L H2O2中含分子数为0.5NA
C.标准状况下,22.4L H2中
D.100 mL 0.1 mol·L-1的FeCl3溶液中含有Fe3+的个数为0.01 NA
难度: 中等查看答案及解析
-
在水电离出的c(H+)=1×10-12 mol/L条件下,下列各组离子一定不能大量共存的是 ( )
A.NH4+、NO3-、Cl-、Na+ B.K+、SO32-、Cl-、NO3-
C.Na+、SO42-、Cl-、HCO3- D.Na+、NO3-、Fe3+、SO42-
难度: 中等查看答案及解析
-
下列水解化学方程式或水解离子方程式正确的是( )
A.CH3COO- + H2O
CH3COOH + OH- B.NH4+ + H2O
NH4OH + H+
C.CH3COOH + NaOH
CH3COONa + H2O D.NaCl + H2O
NaOH + HCl
难度: 简单查看答案及解析
-
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O
Al2O3+3H2↑ 电解过程中,以下判断正确的是( )

难度: 困难查看答案及解析
-
可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应①Br2 + 2e- = 2Br-
②2Br- - 2e- = Br2 ③Zn – 2e- = Zn2+ ④Zn2+ + 2e- = Zn其中表示充电时的阳极反应和放电时的负极反应的分别是( )
A.②和③ B.②和① C.③和① D.④和①
难度: 中等查看答案及解析
-
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,要使溶液中
值增大,可以采取的措施是( )
A.加少量烧碱溶液 B.降低温度 C.加少量冰醋酸 D.加水
难度: 中等查看答案及解析
-
将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c(NH4+)=c(Cl-) ⑤c(NH4+)<c(Cl-)正确的是( )
A.①⑤ B.③④ C.②⑤ D.②④
难度: 中等查看答案及解析
-
100 mL 6 mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速度,但又不影响生成氢气的总量,不可向反应物中加入适量的( )
A.碳酸钠(固体) B.水
C.硫酸钾溶液 D.CH3COONa(固体)
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
 下列叙述不正确的是( )
下列叙述不正确的是( )A.放电时负极反应为:Zn-2e- +2OH-= Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-= FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
难度: 困难查看答案及解析
-
常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是 ( )
A.pH=5.2的CH3COOH与CH3COONa混合溶液中,c(Na+)<c(CH3COO-)
B.在滴加酚酞溶液的氨水中,加入NH4Cl溶液恰好无色,则此时溶液的pH﹤7
C.Na2CO3溶液中,c(OH-)-c(H+)= c(HCO3-)+2 c(H2CO3)
D.pH=2的一元酸溶液与pH=12的NaOH溶液等体积混合,则溶液的pH一定不大于7
难度: 困难查看答案及解析
-
已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数Ksp(CaF2)=1.46×10-10 mol·L-3。现向1L 0.2 mol·L-1 HF溶液中加入1L 0.2 mol·L-1 CaCl2溶液,则下列说法中正确的是( )
A.25℃时,0.1 mol·L-1HF溶液中pH=1 B.KSP(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生 D.以上说法均不正确
难度: 困难查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25 ℃)
K1=1.77×10-4
K1=4.9×10-10
Ki1=4.3×10-7
Ki2=5.6×10-11
下列选项错误的是( )
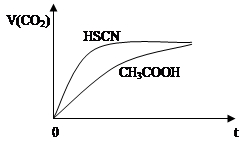
A.2CN-+H2O+CO2 → 2HCN+CO32-
B.2HCOOH+CO32-→ 2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液pH前者小于后者
难度: 困难查看答案及解析
-
在T ℃时, Ba(OH)2的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=4的盐酸,测得混合溶液的部分pH如下表所示:
序号
氢氧化钡溶液的体积/mL
盐酸的体积/mL
溶液的pH
①
22.00
0.00
8
②
22.00
18.00
c
③
22.00
22.00
d
假设溶液混合前后的体积变化可忽略不计,则下列说法不正确的是
A.a = 8 B.b = 4 C.c = 5 D.d = 6
难度: 困难查看答案及解析
-
下列溶液中有关物质的浓度关系正确的是
A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)> c[(NH4)2SO4]> c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
难度: 困难查看答案及解析
-
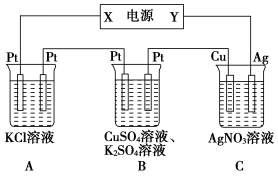
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
选项
X
Y
A
MgSO4
CuSO4
B
AgNO3
Pb(NO3)2
C
FeSO4
Al2 (SO4)3
D
CuSO4
AgNO3

难度: 中等查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C.电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O
D.正极上发生的反应是:O2+4e-+2H2O=4OH-
难度: 中等查看答案及解析
-
配制FeCl3溶液时,为防止其水解,应向溶液中加入少量
A.HCl B.H2O C.NaCl D.NaOH
难度: 简单查看答案及解析
-
已知:25℃时, Ksp[Mg(OH)2] = 5.61×10-12、Ksp [MgF2] =7.42×101。下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化成MgF2
难度: 困难查看答案及解析
-
pH=2的两种一元酸X和Y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )
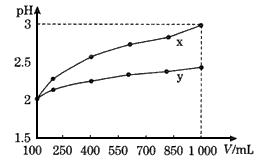
A.x为弱酸,Vx<Vy
B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy
D.y为强酸,Vx>Vy
难度: 困难查看答案及解析
-
室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00ml 0.100 mol·L-1 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是

A.II表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗V(NaOH)小于20ml
C.V(NaOH) =20.00ml时,两份溶液中c(Cl—)=c(CH3COO—)
D.V(NaOH) =10.00ml时,醋酸溶液中:c(Na+)>c(CH3COO—)>c(H+ )>c(OH—)
难度: 困难查看答案及解析
-
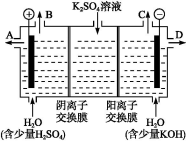
液流电池是一种新型可充电的高性能蓄电池,其工作原理如下图。两边电解液存储罐盛放的电解液分别是含有V3+、V2+的混合液和VO2+、VO2+酸性混合液,且两极电解液分开,各自循环。下列说法不正确的是( )
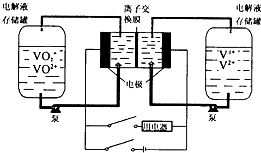
A.充电时阴极的电极反应是V3++e-=V2+
B.放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被氧化
C.若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol
D.若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐
难度: 困难查看答案及解析