-
(1)比较下列化合物熔沸点的高低(填“>”或“<”)。
①CO2____SO2 ②NH3____PH3 ③O3____O2
④Ne____Ar ⑤CH3CH2OH____CH3OH ⑥CO____N2
(2)已知AlCl3的熔点为190 ℃(2.202×105 Pa),但它在180 ℃即开始升华。请回答:
①AlCl3固体是____晶体。
②设计一个可靠的实验,判断氯化铝是离子化合物还是共价化合物。你设计的实验是____________。
难度: 中等查看答案及解析
-
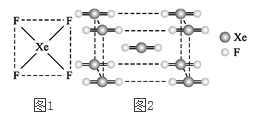
自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
(1)请根据XeF4的结构示意图(图1)判断这个分子是极性分子还是非极性分子?________。
(2)XeF2晶体是一种无色晶体,图2为它的晶胞结构图。XeF2晶体属于哪种类型的晶体?___。
难度: 简单查看答案及解析