-
化学与环境、材料、信息、能源关系密切,下列说法正确的是( )
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
C.PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
D.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
B.一定温度下,1L0.50mol/LNH4NO3溶液中含氮原子个数为NA
C.过氧化氢分解制得标准状况下1.12LO2,转移电子数目为0.2NA
D.28g分子式为CnH2n的链烃中含有的C-H键的数目为2NA
难度: 简单查看答案及解析
-
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的一半。下列说法正确的是( )
A.原子半径:W>Z>Y>X>M
B.将XZ2通入W单质与水反应后的溶液中,一定只生成一种盐
C.由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键
D.CaX2、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2
难度: 中等查看答案及解析
-
常温下,0.2mol•L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度所示,下列说法正确的是( )
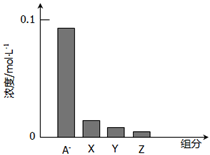
A.HA为强酸
B.该混合溶液pH=7.0
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
难度: 简单查看答案及解析
-
利用如图装置可以进行实验并能达到实验目的是( )
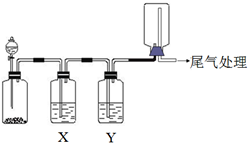
选项
实验目的
X中试剂
Y中试剂
A
用MnO2和浓盐酸制取并收集纯净干燥的Cl2
饱和食盐水
浓硫酸
B
用Cu与稀硝酸制取并收集纯净干燥的NO
水
浓硫酸
C
验证电石与饱和食盐水反应生成的气体的性质并收集
CuSO4溶液
KMnO4
溶液
D
CaCO3和稀盐酸制取并收集纯净干燥的CO2
饱和NaHCO3溶液
浓硫酸
难度: 中等查看答案及解析
-
联苯(结构如图所示
,碳碳单键可以旋转)的二氯代物有( )
A.9种 B.12种 C.20种 D.24种
难度: 中等查看答案及解析
-
电解NO制备NH4NO3,其工作原理如图所示,下列说法不正确的是( )

A.b极的电极反应为:NO-3e-+2H2O=NO3-+4H+
B.溶液中的H+由电极a处向电极b处迁移
C.电解过程总反应的化学方程式为:8NO+7H2O
3NH4NO3+2HNO3
D.为使电解产物全部转化为NH4NO3,需补充的物质A是NH3
难度: 中等查看答案及解析





 )
)