-
化学与生产、生活密切相关。下列叙述中正确的是
A.用浓H2SO4刻蚀工艺玻璃上的纹饰
B.高纯度的硅单质广泛用于制作光导纤维
C.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
D.制饭勺、饭盒、高压锅等的不锈钢是合金
难度: 中等查看答案及解析
-
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移、定容等操作。下列图示对应的操作规范的是

难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.11.2L NO2含氧原子数为NA
B.标准状况下,14g CO所含质子数为7NA
C.22g 某气体含分子数为0.5 NA,则其摩尔质量为44
D.25℃,101kPa 条件下,1.4g N2的体积是1.12L
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
①无色溶液中:K+、Na+、Cu2+、SO42-
②使酚酞溶液变红的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、Na+
④无色透明溶液中:SiO32-、Na+、Cl-、OH-
A.①② B.③④ C.②④ D.①④
难度: 中等查看答案及解析
-
下列叙述正确的是
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2CO3溶液和NaHCO3溶液都能跟Ca(OH)2溶液反应得到白色沉淀
③钠在常温下不容易被氧化,加热下被氧化成白色固体
④Na2O2可作供氧剂,而Na2O不行
⑤Na2CO3溶液和NaHCO3溶液都呈碱性
A.都正确 B.②③④⑤ C.②③⑤ D.②④⑤
难度: 中等查看答案及解析
-
下表所列各组物质中,物质之间不能通过一步反应就能实现如图所示转化的是
物质
选项
a
b
c
A
SiO2
Na2SiO3
H2SiO3
B
C
CO
CO2
C
Fe
FeCl2
FeCl3
D
CuO
Cu(OH)2
CuCl2
难度: 中等查看答案及解析
-
下列各项操作中不发生先沉淀后溶解现象的是
A.向石灰水中通入过量CO2
B.向Fe(OH)3胶体中逐滴加入过量H2SO4溶液
C.足量NaOH溶液中逐滴加入Al2(SO4)3溶液
D.向NaAlO2溶液中逐滴加入盐酸至过量
难度: 中等查看答案及解析
-
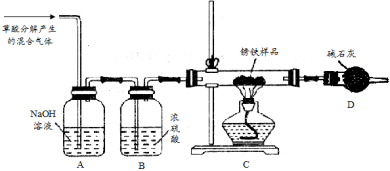
对4FeCl2+4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8NaCl,下列说法错误的是
A.Fe(OH)3既是氧化产物又是还原产物
B.氧气是氧化产物
C.做氧化剂的过氧化钠和做还原剂的过氧化钠物质的量之比为3:1
D.过氧化钠只做氧化剂
难度: 中等查看答案及解析
-
已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行氯气的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
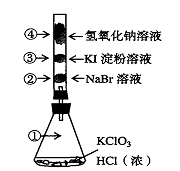
①
②
③
④
A
黄绿色
橙色
蓝色
无色
B
无色
橙色
紫色
白色
C
黄绿色
橙色
蓝色
白色
D
黄绿色
无色
紫色
白色
难度: 中等查看答案及解析
-
将标准状况下的V L HCl溶于1000g水中,得到的盐酸密度为ρ g/cm3,则该盐酸的物质的量浓度为
A.
mol/L B.
mol/L
C.
mol/L D.
mol/L
难度: 简单查看答案及解析
-
除去下列括号内的杂质,所加试剂和操作均正确的是
选项
需除杂的物质
试剂
操作
A
NaCl(Na2CO3)
稀盐酸
蒸发结晶
B
CO2(HCl)
饱和Na2CO3溶液
洗气
C
Cl2(H2O)
碱石灰
洗气
D
CO2(CO)
————
点燃
难度: 简单查看答案及解析
-
两种金属混合物共15g,投入足量的盐酸中,充分反应得11.2L H2(标准状况),则原混合物组成中肯定不能为下列的
A.Mg、Ag B.Fe、Mg C.Al、Zn D.Mg、Al
难度: 简单查看答案及解析
-
铁、铜混合粉末18.0g加入到100mL 5.0 mol/L FeCl3溶液中,剩余固体质量为3.2g,下列说法正确的是
A.剩余固体是铁、铜混合物
B.反应后溶液中n(Fe2+)+ n(Cu2+)=0.75 mol
C.反应后溶液中n(Fe3+)=0.10 mol
D.原固体混合物中铜的质量是8.0g
难度: 简单查看答案及解析
-
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示。下列关于整个反应过程中的叙述错误的是
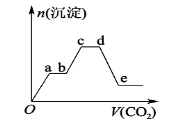
A.Oa段反应的化学方程式是Ba(OH)2+CO2 =BaCO3↓+H2O
B.bc段与cd段所消耗CO2的体积相同
C.bc段反应的离子方程式是2AlO2-+3H2O+CO2 = 2Al(OH)3↓+CO32-
D.de段沉淀减少是由于BaCO3固体的消失
难度: 中等查看答案及解析