-
化学与人类生产、生活密切相关,下列说法错误的是()
A.采用催化抟化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毐气体
B.“雾霾天气” “温室效应” “光化学烟雾”的形成都与氮的氧化物无关
C.利用风能.太阳能等淸洁能源代替化石燃料,可减少环境污染
D.氮化硅陶瓷是一种新型无机非金属材料
难度: 简单查看答案及解析
-
对于任何一个化学平衡体系,采取以下措施,一定会使平衡发生移动的是( )
A.加入一种反应物 B.增大体系压强 C.使用催化剂 D.升高温度
难度: 简单查看答案及解析
-
恒温恒容下,反应A(g)+B(g)=2C(g)的平衡常数为4,现向该容器中投入lmol的C物质, 平衡时,C的转化率为()
A.20% B.33% C.50% D.89%
难度: 简单查看答案及解析
-
下列各组关于强电解质.弱电解质电解质的归类,完全正确的是( )
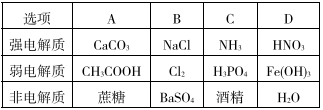
难度: 简单查看答案及解析
-
能证明醋酸是弱酸的是( )
①醋酸能使紫色石蕊试液变红
②醋酸能被氨水中和
③常温下醋酸钠溶液的pH大于7
④常温下,0.10mol/L醋酸溶液中的c(H+ )为1.32×10-3mol/L
A.①③④ B.②③ C.③④ D.①④
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 强电解质溶液一定比弱电解质溶液的导电性强
B. 强电解质的稀溶液中不存在溶质分子
C. 强电解质都是离子化合物,而弱电解质都是共价化合物
D.不同的弱电解质只要物质的量的浓度相同,电离程度也相同
难度: 简单查看答案及解析
-
某温度下,体积一定的密闭容器中发生如下可逆反应X(g)+mY(s)
3Z(g) △H,下列说法正确的是( )
A.气体的平均密度不变时.说明达到了平衡状态
B.加入少量的X,△H变大
C.加入一定量:的惰性气体,平衡向左移动
D.加入少量的Y正反应速率加快
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A.化学平衡向正向移动,反应物浓度一定降低
B.化学平衡向正向移动,生成物的浓度一定增加
C.化学平衡向正向移动,反应物的转化率一定增大
D.化学平衡向正向移动时,正反应速率一定大于逆反应速率
难度: 简单查看答案及解析
-
—定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),平衡时 X、Y、Z 的浓度分别为 0.1 mol / L、0.3 mol /L、0.08mol/L, 则下列判断正确的( )
A.c1:c2=3:1
B.平衡时.Y和Z的生成速率之比为2:3
C.X、Y的转化率不相等
D.c1的取值范围为0mol/L<c1<0.14mol/L
难度: 中等查看答案及解析
-
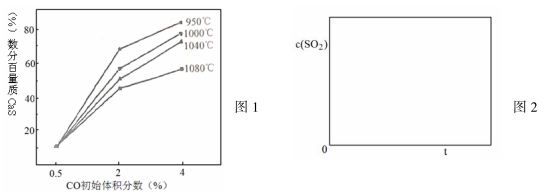
在恒容密闭容器中存在下列平衡CO(g)+H2O(g)
CO2(g)+H2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是( )
A.反应CO(g)+H2O(g)
CO2(g)+H2(g) 的△H>0
B.在T2时,若反应处于状态D,则一定有v正<v逆
C.平衡状态A与C相比,平衡状态A的c(CO)小
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
难度: 困难查看答案及解析
-
同温下,向甲(保持恒容)乙(保持恒压)两个容器中分别加入物质的量均为1mol的A与B发生可逆反应A(g)+B(g)
C(g),起始时两容器的体积相等,达到平衡状态后,下列说法正确的是( )
A.容器甲中分子总数多 B.容器甲中C的浓度大
C.容器甲中反应速率快 D.容器甲中转化率大
难度: 困难查看答案及解析
-
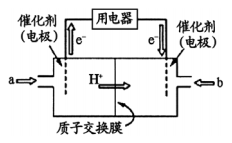
图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是新型氢氧燃料电池,其电解质为固体氧化物电解质,则下列说法中不正确的是( )
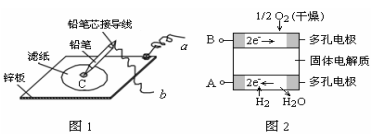
A. 图2电池放电过程屮,O2-从B极区向A极区迁移
B. 图2电池负极区的电极反应为H2-2e-+O2-=H2O
C. 若用氯化钠和酚酞混合溶液浸湿滤纸,用导线将a、b直接相连,则铅笔芯C点处出现红色
D.若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯C点处出现蓝色,则b接的是A电极
难度: 困难查看答案及解析
-
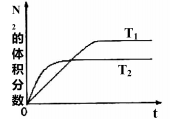
如图是温度和压强对反应X+Y
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
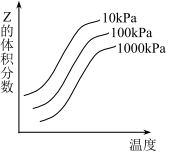
A. 上述可逆反应的正反应为放热反应
B. X、Y、Z均为气态
C. X和Y中只有一种为气态,Z为气态
D. X、Y均为非气态
难度: 困难查看答案及解析
-
在一固定容积的密闭容器中充入2mol NO2,一定温度下建立如下平衡:2 NO2(g)
N2O4(g),此时平衡混合气体中NO2的体积分数为x%;若再充入1mol N2O4,在温度不变的情况下, 达到新平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是 ( )
A.x>y B.x=y C.x<y D.不能确定
难度: 中等查看答案及解析
-
室温下向10mLpH=3的醋酸溶液中加入水稀释后.下列说法正确的是( )
A.溶液中导电粒子的数目减少 B.溶液中醋酸根浓度与醋酸分了浓度比值变大
C.醋酸的电离程度增大,c(H+)亦增大 D.溶液的导电能力增强
难度: 中等查看答案及解析
-
中国首个空间实验室——“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氣燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,a、b、c、d均为Pt电极。 下列说法正确的是( )
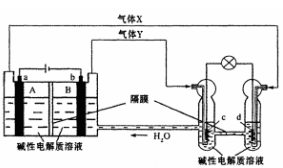
A. B区的OH-通过隔膜向a电极移动,A 区pH增大
B. 图中右管中的OH-通过隔膜向c电极移动,d电极上发生还原反应
C. c是正极,电极上的电极反应为2H++2e-=H2↑
D. 当有lmol电子转移时,b电极产生气体Y的体积为11.2L
难度: 极难查看答案及解析
-
研究化学反应原理对于生产、生活及环境保护具有重要意义。已知:Cu(s)+2H+(aq)=Cu2+(aq)+H2(g); △H= +64.39KJ• mol-1
2H2O2(l)= 2H2O (l)+O2(g); △H= -196.46 kJ • mol-1
H2(g)+1/2O2(g)=H2O (l); △H=-285.84 kJ• mol-1
则H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的△H为
A.+319.68 KJ• mol-1 B.+259.7 KJ• mol-1
C.-319.68 KJ• mol-1 D.-259.7 KJ• mol-1
难度: 中等查看答案及解析
-
恒温下,在2个体积相等的恒容密闭容器中反应2A(g)+B(g)
3C(g)达到平衡,若甲容 器起始投入2molA、1molB,乙容器起始投入1molC,下列说法正确的是( )
A.两容器内压强一定相等 B.两容器中A的浓度一定相等
C.两容器吸收或放出的热量一定相等 D.两容器中B的百分含量一定相同
难度: 中等查看答案及解析
-
人体吸入CO后在肺中发生反应CO+HbO2
O2+HbCO导致人体缺氧。向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L],氧合血红蛋白 HbO2浓度随时间变化曲线如图所示。下列说法正确的是( )
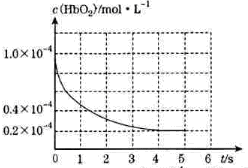
A.反应开始至4s内用HbO2表示的平均反应速率为2×l0-4mol/(L·s)
B.反应达平衡之前,O2与HbCO的反应速率逐渐减小
C.将CO中毒病人放入高压氧舱治疗是利用了化学平衡移动原理
D.该温度下反应CO+HbO2
O2+HbCO的平衡常数为107
难度: 极难查看答案及解析
-
—定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)
CH3OH(g)达到平衡。下列说法错误的是( )
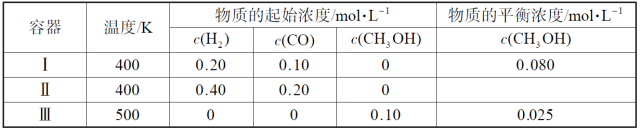
A.该反应的正反应放热
B.达到平衡时,容器I中反应物转化率比容器II中的小
C.达到平衡时,容器II中c(H2)大于容器III中的两倍
D.达到平衡时,容器III中的正反应速率比容器I中的大
难度: 困难查看答案及解析
-
在一定温度下,向2 L恒容密闭容器中充入1mol A,发生A(g)
B(g) + C(g)反应。反应过程中c(C)随时间变化的曲线如下图所示,下列说法不正确的是( )
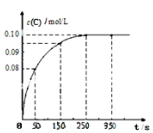
A.反应在 0 ~50 s 的平均速率v(C)=1.6×10-3mo1/(L • s)
B.该温度下,反应的平衡常数值为0.025
C.反应平衡后,再向容器中充入A、B、C各1mol,此时v(正)<v(逆)
D.保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0
难度: 困难查看答案及解析