-
下列说法正确的是
A.16O和18O互为同位素 B.漂粉精、液氯、干冰均为混合物
C.稀硫酸、氨水均为电解质 D.溶于水能电离出H+ 的物质一定是酸
难度: 中等查看答案及解析
-
下列叙述不正确的是
A B C D



闪电时会发生反应:
N2+O2
2NO 利用丁达尔效应证明烧杯中的分散系是胶体 蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 加热时熔化的铝不滴落,证明Al2O3的熔点比Al高
难度: 中等查看答案及解析
-
如图是元素周期表的一部分,下列关系正确的是
S
Cl
Se
Br
A.还原性:Se2->S2->C1- B.热稳定性:HC1>H2Se>HBr
C.原子半径:Se>C1>S D.酸性:HBrO4>HClO4>H2SO4
难度: 中等查看答案及解析
-
下列说法不正确的是
A.柠檬虽然酸味较浓,但属于碱性食物
B.向煤中加入适量的石灰石,可以减少燃烧产物中SO2的量
C.氧化铝是冶炼金属铝的原料,也是一种比较好的耐火材料
D.石英是良好的半导体材料,可以制成光电池,将光能直接转化成电能
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1mol Na2O2固体中含有O22- 2 NA
B.常温常压下,3.2 g CH4中含有电子2 NA
C.标准状况下,11.2 L CH3CH2OH中含有分子0.5NA
D.100 mL 1 mol·L-1的CH3COOH溶液中含有CH3COOH分子0.1 NA
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.用电子式表示HCl的形成过程:

B.
中的原子核内的中子数与核外电子数之差是99
C.在空气中加热金属锂:4Li+O2
2Li2O
D.铝热法炼铁:2Al+Fe2O3
2Fe+ Al2O3
难度: 中等查看答案及解析
-
在pH=13的无色溶液中,下列各组离子能大量共存的是
A.K+、Na+、HCO3- 、NO3- B.Na+、NH4+、NO3-、Cl-
C. K+、Na+、NO3-、Br - D.K+、Cu2+、Cl-、SO42-
难度: 中等查看答案及解析
-
向某无色溶液中分别进行下列操作,所得现象和结论正确的是
A.加入氨水,产生白色沉淀,证明原溶液中存在Al3+
B.加入AgNO3溶液,产生白色沉淀,证明原溶液中存在Cl-
C.加入盐酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中存在SO42-
D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在NH4+
难度: 中等查看答案及解析
-
用如图所示装置进行实验,下列对实验现象的解释不合理的是
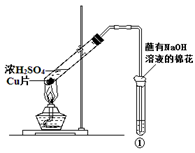
①中试剂 ①中现象 解 释
A Ba(NO3)2溶液 生成白色沉淀 SO32-与Ba2+生成白色BaSO3沉淀
B 品红溶液 溶液褪色 SO2具有漂白性
C 紫色石蕊溶液 溶液变红 SO2与水反应生成酸
D 酸性KMnO4溶液 紫色褪去 SO2具有还原性
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.Cu(OH)2中加入硫酸:OH-+H+ =H2O
B.钠加入水中:Na +2H2O=Na++2OH-+H2↑
C.FeSO4溶液中加入稀硝酸:3Fe2++4H++NO3- =3Fe3++2H2O+NO↑
D.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO42-+ 3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓
难度: 中等查看答案及解析
-
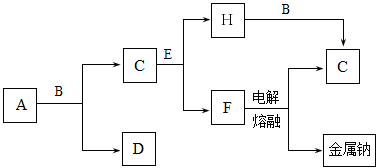
下列物质间的转化在给定条件下能实现的是
①
②
③
④
A.②④ B.③④ C.①④ D.①②③
难度: 中等查看答案及解析
-
下列图中的实验方案,能达到实验目的的是
A B C D
实验方案
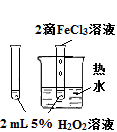
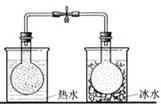
将NO2球浸泡在冰水和热水中
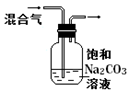
实验
目的 验证FeCl3对H2O2分解反应有催化作用 探究温度对平衡
2NO2
N2O4的影响 除去CO2气体中混有的SO2 比较HCl、H2CO3和H2SiO3的酸性强弱
难度: 中等查看答案及解析
-
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是
A.化合物KCrO2中Cr元素为+3价
B.实验①证明Cr2O3是两性氧化物
C.实验②证明H2O2既有氧化性又有还原性
D.实验③证明氧化性:Cr2O72- > I2
难度: 中等查看答案及解析
-
已知反应X (g)+Y (g)
n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是
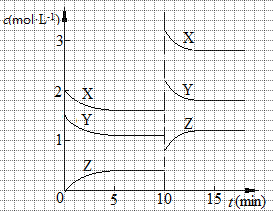
A.反应方程式中n=1
B.10 min时,曲线发生变化的原因是升高温度
C.10 min时,曲线发生变化的原因是增大压强
D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-1
难度: 困难查看答案及解析