-
下列反应中生成物总能量高于反应物总能量的是
A. 碳酸钙受热分解 B. 乙醇燃烧
C. 铝粉与氧化铁粉末反应 D. 氧化钙溶于水
难度: 中等查看答案及解析
-
下列说法中不正确的是
A.体系有序性越高,熵值就越低 B.自发过程将导致体系的熵增大
C.吸热反应不可以自发进行 D.同种物质气态时熵值最大
难度: 简单查看答案及解析
-
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)==2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
(3)H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1,
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变ΔH为( )
A.488.3 kJ·mol-1 B.-244.15 kJ·mol-1
C.244.15 kJ·mol-1 D.-488.3 kJ·mol-1
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B. 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C. 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D. 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
难度: 中等查看答案及解析
-
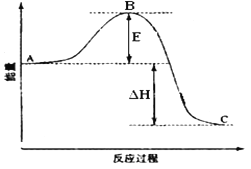
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应下列叙述不正确的是
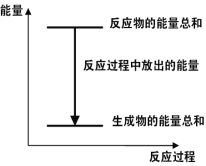
A.反应过程中能量关系可用上图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池则锌为负极
D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
难度: 中等查看答案及解析
-
下列能够使反应:Cu+2H2O=Cu(OH)2+H2↑获得成功的是
A. Cu与稀H2SO4发生反应
B. 铜一锌合金在潮湿的空气中发生反应被腐蚀
C. 用铜片作阴、阳电极,电解氯化钠溶液
D. 用铜片作阴、阳电极,电解硫酸溶液
难度: 中等查看答案及解析
-
以NA代表阿伏加德罗常数,则关于热化学方程式:C2H2(g)+5/2O2(g)=2CO2(g)+2H2O(1)△H=-1300.0 kJ·mol-1 的说法中,正确的是
A. 当有10NA个电子转移时,该反应就放出1300kJ的能量
B. 当有NA个水分子生成且为液态时,吸收1300kJ的能量
C. 当有22.4LC2H2(乙炔)完全燃烧生成CO2和液态H2O(l)时,该反应就放出1300kJ的能量
D. 当有8NA个碳氧共用电子对生成时,该反应就吸收1300kJ的能量
难度: 中等查看答案及解析
-
我国科学家成功研制出一种全新的铝—石墨双离子电池(AGDIB)。这种新型AGDIB电池采用廉价且易得的石墨作为电池正极材料,铝锂(AlLi)合金作为负极材料,LiPF6是电解质,碳酸酯为溶剂,反应原理是 AlLi + Cx(PF6)
LiPF6 + xC + Al。
下列关于该电池的说法不正确的是
A. 该电池不能用水溶液作为电解质
B. 放电时,Li+在电解质中由负极向正极迁移
C. 充电时,若转移1 mol e—,阴极电极将增重7g
D. 放电时,正极的电极反应式为AlLi-e-=Li+ + Al
难度: 中等查看答案及解析
-
从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程。已知键能数据如下表:
化学键
N≡N
N—H
H—H
键能(kJ/mol)
942
391
b
反应N2(g)+3H2(g)
2NH3(g);△H= —93kJ·mol-1。试根据表中所列键能数据计算b数值:
A. 551 B. 437 C. 558 D. 160
难度: 中等查看答案及解析
-
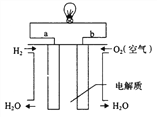
如图所示,下列说法不正确的是
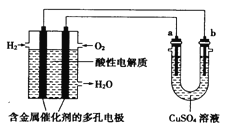
A. 燃料电池中正极反应为1/2O2(g)+2e-+2H+=H2O
B. 当燃料电池消耗1 mol H2时,导线中转移2 mol电子
C. 当此装置用于铁表面电镀铜时,a为铁,电镀过程中,硫酸铜溶液浓度基本不变
D. 若a为粗铜,b为纯铜,该装置可用于铜的精炼
难度: 中等查看答案及解析
-
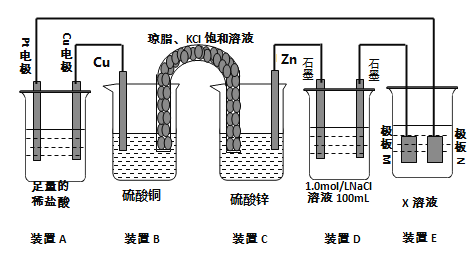
关于以下装置的描述正确的是( )
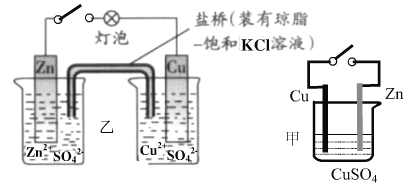
A. 乙装置工作时, CuSO4溶液中可能出现K+,ZnSO4溶液中可能出现Cl-
B. 甲、乙的电路中各转移 1 mol电子时,溶液中各生成1 mol ZnSO4
C. 取出盐桥,灯泡仍可发光
D. 甲、乙两装置中的总反应式不可能相同
难度: 中等查看答案及解析
-
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,NH3被氧化为常见无毒物质.下列说法错误的是( )

A. 溶液中K+向电极b移动
B. 反应消耗的NH3与O2的物质的量之比为4:5
C. 氨气在电极a上发生氧化反应
D. 正极的电极反应式为:O2+4e﹣+2H20=4OH﹣
难度: 中等查看答案及解析
-
埋在地下的钢管道可以用下图所示方法进行电化学保护。下列说法正确的是
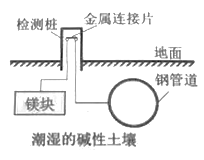
A. 该方法是将化学能转化成了电能
B. 在此装置中钢管道做负极
C. 该方法称为“外加电流阴极保护法”
D. 镁块上发生的电极反应:O2+2H2O+4e→4OH-
难度: 中等查看答案及解析
-
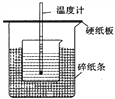
某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )
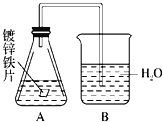
A. B中导气管里形成一段水柱
B. B中导气管中产生气泡
C. 金属片剪口处溶液变红
D. 锌被腐蚀
难度: 中等查看答案及解析
-
用下列装置能达到预期目的的是
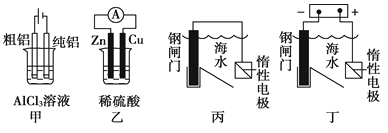
A.甲图装置可用于电解精炼铝
B.乙图装置可得到持续、稳定的电流
C.丙图装置利用了牺牲阳极的阴极保护法保护钢闸门不被腐蚀
D.丁图装置利用了外加电流的阴极保护法保护钢闸门不被腐蚀
难度: 中等查看答案及解析
-
下列有关说法不正确的是( )
A. 实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B. 铅蓄电池在放电过程中,负极和正极质量均增加
C. 在硫酸型酸雨地区,不纯的铜发生电化学腐蚀,正极反应为:O2+4e-+4H+=2H2O
D. 生铁发生吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e- =Fe2+
难度: 中等查看答案及解析