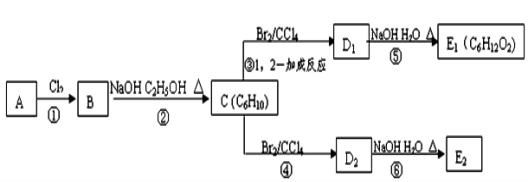
-
下列可用于测定溶液pH且精确度最高的是
A.酸碱指示剂 B. pH计 C.精密pH试纸 D.广泛pH试纸
难度: 简单查看答案及解析
-
将纯水加热至较高温度,下列叙述正确的是
A.水的离子积变大、pH变小、呈酸性
B.水的离了积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积变大、pH变小、呈中性
难度: 简单查看答案及解析
-
下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污 B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭味
难度: 中等查看答案及解析
-
要检验某溴乙烷中的溴元素,正确的实验方法是( )
A、加入氯水振荡,观察水层是否有红棕色出现
B、滴入AgNO3溶液,再加入稀HNO3,观察有无浅黄色沉淀生成
C、取少许,加入NaOH溶液共热,然后加入稀HNO3使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成
D、加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成
难度: 中等查看答案及解析
-
用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构如下:( )
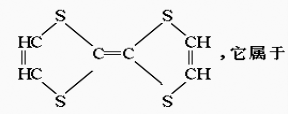
A.无机物 B.烃 C.高分子化合物 D.有机物
难度: 简单查看答案及解析
-
描述CH3—CH=CH—C≡C—CF3分子结构的下列叙述中,正确的是( )
A.6个碳原子有可能都在一条直线上;
B.6个碳原子不可能在一条直线上;
C.该有机物中所有原子有可能都在同一个平面上;
D.6个碳原子不可能都在同一个平面上.
难度: 中等查看答案及解析
-
在2A(g)+B(g)
3C(g)+4D(g)反应中表示该反应速率最快的是 ( )
A.v(A)=0.5mol/(L· s) B.v(B)=0.3mol/(L· s)
C.v(C)=0.8mol/(L· s) D.v(D)=1mol/(L· s)
难度: 简单查看答案及解析
-
在容积不变的密闭容器中,一定条件下发生反应:2A(?)
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
A、若正反应是吸热反应,则A为非气态
B、若正反应是放热反应,则A为非气态
C、在平衡体系中加入少量C,该平衡向逆反应方向移动
D、改变压强对该平衡的移动一定无影响
难度: 中等查看答案及解析
-
分子式为C5H7Br 的有机物,不可能是( )
A、只含有1个双键的直链有机物 B、含有2个双键的直链有机物
C、含有1个双键的环状有机物 D、含有1个叁键的直链有机物
难度: 中等查看答案及解析
-
下列化合物的正确命名是( )
A、2,2-二乙基丁烷 B、3-甲基-2-乙基戊烷
C、2-乙基-3甲基-戊烷 D、3,4-二甲基己烷
难度: 中等查看答案及解析
-
下列实验,能成功的是( )
A、苯和溴水、铁屑混合制溴苯
B、用溴水除乙烷中混有的乙烯
C、苯与浓硝酸和浓硫酸的混合物共热至70℃~80℃制硝基苯
D、用酒精和浓盐酸通过加热来制取乙烯
难度: 中等查看答案及解析
-
分子式为C8H10的芳香烃,其结构有( )
A、3种 B、4种 C、5种 D、6种
难度: 中等查看答案及解析
-
常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是( )
A、溶液中由水电离产生的H+浓度为1×10-7 mol/L
B、c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L
C、溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D、溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是 ( )
编号
HX
YOH
溶液的体积关系
①
强酸
强碱
V(HX)=V(YOH)
②
强酸
强碱
V(HX)<V(YOH)
③
强酸
弱碱
V(HX)=V(YOH)
④
弱酸
强碱
V(HX)=V(YOH)
A、①③ B、②③ C、①④ D、②④
难度: 中等查看答案及解析
-
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是( )
A、向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
B、将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L
C、因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生
D、除去工业废水中的Cu2+可以选用FeS作沉淀剂
难度: 困难查看答案及解析
-
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,错误的是( )
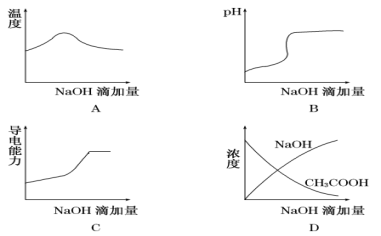
难度: 中等查看答案及解析