-
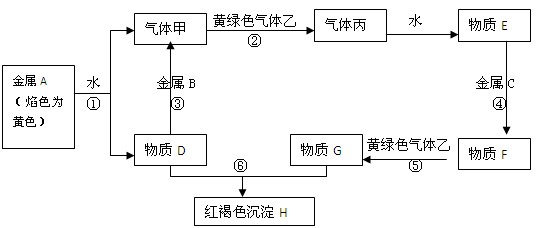
著名化学家、诺贝尔化学奖获得者Glenn Theodore Seabory1979年在美国化学会成立100周年大会上指出:“化学,是人类进步的关键!”。 学习和研究化学是为了更好的认识世界。下列涉及的内容一般不属于化学研究范围的是
A.研究一种新材料的性质和用途 B.研究一种新微粒的组成和结构
C.研究一种新药品的合成 D.研究一种新物质的运动规律
难度: 简单查看答案及解析
-
海洋是一个巨大的宝藏,期待着人们的开发和利用。下列物质不经过化学变化就能从海水中获得的是
A.单质溴 B.单质镁 C.食盐 D.烧碱
难度: 简单查看答案及解析
-
下列反应中化合物作还原剂的是
A.2Na+2H2O = 2NaOH+H2 B.Cl2+2NaBr = 2NaCl+Br2
C.SiCl4 +2H2 = Si + 4HCl D.C+H2O = CO+H2
难度: 简单查看答案及解析
-
下列各项中表达正确的是
A.质量数为37的氯原子:
B. 镁的原子结构示意图:
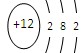
C.溴化银的化学式: AgBr2 D.NaOH在水中的电离方程式:NaOH= Na+ +O2—+H+
难度: 简单查看答案及解析
-
下列物质分离方法不正确的是
A.用过滤的方法除去食盐水中的泥沙 B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘 D.用分液的方法分离汽油和氯化钠溶液
难度: 简单查看答案及解析
-
下列有关物质的保存方法,正确的是
A.漂白粉存放在敞口容器中
B.少量的钠保存在酒精中
C.新制的氯水通常保存在棕色玻璃试剂瓶中
D.氢氧化钠溶液用带磨口玻璃塞的普通试剂瓶贮存
难度: 简单查看答案及解析
-
下列反应既是氧化还原反应又是离子反应的是
A.碳在二氧化硅反应 B.二氧化碳通入澄清石灰水中
C.氯化钠溶液中滴加硝酸银溶液 D.锌粒投入稀硫酸中
难度: 简单查看答案及解析
-
下列元素中金属性最强的是
A.K B.Na C.Al D.Mg
难度: 简单查看答案及解析
-
硅是带来人类文明的重要元素之一,下列物质中主要成分是硅酸盐的是
A. 大理石 B.金刚石 C.水晶 D.陶瓷
难度: 简单查看答案及解析
-
下列各组离子在溶液中能大量共存的是
A. Ba2+、C1-、
、K+ B. Fe3+、OH-、
、Na+
C. Ca2+、
、C1-、K+ D. Ag+、
、Cl-、K+
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
B. 碳酸钙与盐酸反应:CO32—+2H+=H2O+CO2↑
C. 石英与烧碱溶液反应 SiO2+2OH-=SiO32-+H2O
D. 氯化铜溶液与铁粉反应:Cu2++Fe=Fe3++Cu
难度: 简单查看答案及解析
-
能用离子方程式H++OH-=H2O表示的反应是
A.稀醋酸和稀氨水反应 B.稀硫酸和烧碱溶液反应
C.稀盐酸和氢氧化铜反应 D.稀硫酸和氢氧化钡溶液反应
难度: 简单查看答案及解析
-
同温同压下,两种气体的体积如果不相同,请你推测其主要的原因是
A.气体的分子大小不同 B.气体分子的物质的量不同
C.气体分子的化学性质不同 D.气体分子间的平均距离不同
难度: 简单查看答案及解析
-
将下列物质按酸、碱、盐、电解质分类排列,正确的是
A.硫酸、烧碱、小苏打、纯碱 B.硅酸、纯碱、食盐、盐酸
C.盐酸、乙醇、氯化钠、碘酒 D.硝酸、漂白粉、石灰石、二氧化碳
难度: 简单查看答案及解析
-
在某些食品包装盒内常有一小包灰黑色粉末。将该粉末溶于盐酸,取上层清液,滴加几滴氯水后,再滴加KSCN溶液,出现血红色。关于该粉末的叙述正确的是
A.一定含有Fe元素 B.一定含有Mg元素
C.一定禽含有Cu元素 D.一定含有Al元素
难度: 简单查看答案及解析
-
在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一
致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C.加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
难度: 简单查看答案及解析
-
下列说法错误的是
A. 胶体具有丁达尔现象
B. 热稳定性:Na2CO3>NaHCO3
C. 表示Na2CO3和NaHCO3分别与Ba(OH)2溶液反应的离子方程式相同
D. 等质量的Na2CO3和NaHCO3分别与等浓度的HCl溶液完全反应,后者消耗的盐酸少
难度: 简单查看答案及解析
-
某中的一种或几种。向该溶液中加入NaOH溶液出现白色沉淀,若加稀硫酸也出现白色沉淀并放出气体,下列判断正确的是
A.肯定含BaCl2 B. 肯定含MgCl2
C.肯定有Na2CO3 D.肯定没有NaHCO3
难度: 简单查看答案及解析
-
既能跟盐酸反应,又能跟氢氧化钠溶液反应的盐是
A.Na2CO3 B. NaHCO3 C.MgO D.Al(OH)3
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,以下说法中不正确的是
A.25℃、1.01×105Pa时,NA个氢分子的体积约是22.4L
B.27g金属Al与足量的稀硫酸反应时生成的H2的分子数为1.5NA
C.常温常压下,n mol HD含有核外电子数为2NA
D.常温常压下,36g18O2中所含的中子数为20NA
难度: 简单查看答案及解析
-
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.400 mol/L。则原混合物中氧化铁的质量是
A.2.4g B.3.36g C.5.60g D.6.4g
难度: 简单查看答案及解析