-
2010年,中国首次应用六炔基苯在铜片表面合成了石墨炔薄膜(其合成示意图如图所示),其特殊的电子结构将有望广泛应用于电子材料领域.下列说法不正确的是( )

A.六炔基苯的化学式为C18H6
B.六炔基苯和石墨炔都具有平面型结构
C.六炔基苯和石墨炔都可发生加成反应
D.六炔基苯合成石墨炔属于加聚反应
难度: 中等查看答案及解析
-
黑索金是一种爆炸力极强的烈性炸药,比TNT猛烈1.5倍,.可用浓硝酸硝解乌洛托品得到黑索金,同时生成硝酸铵甲醛(HCHO).则反应中乌洛托品与硝酸的物质的量之比为( )

A.2:3 B.1:3 C.1:4 D.2:5
难度: 困难查看答案及解析
-
下列设计的实验方案不能达到实验目的是( )
A.探究催化剂对H2O2分解速率的影响:在相同条件下,向一试管中加入2mL5%H2O2和1mLH2O,向另一试管中加入2mL 10%H2O2和1mLFeCl3溶液,观察并比较实验现象
B.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水
C.检验溶液中是否含有Fe2+:取少量待检验溶液,滴加KSCN溶液,再向其中加入少量新制氯水,观察实验现象
D.制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液
难度: 中等查看答案及解析
-
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
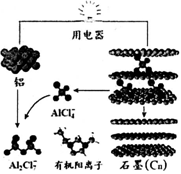
A.放电时,铝为负极、石墨为正极
B.放电时,有机阳离子向铝电极方向移动
C.放电时的负极反应为:Al-3e-+7AlCl4-═4Al2Cl7-
D.充电时的阳极反应为:Cn+AlCl4--e-═CnAlCl4
难度: 中等查看答案及解析
-
如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
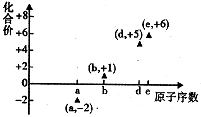
A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.工业上常用电解法制备单质b和c
D.a和b形成的化合物不可能含共价键
难度: 困难查看答案及解析
-
工业生产苯乙烯是利用乙苯的脱氢反应:
△H>0
针对上述反应,有人提出如下观点.其中合理的是
A.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强一定的条件下,充入不参加反应的气体,有利于提高苯乙烯的产率
C.在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量在不断增大
D.不断分离出苯乙烯可加快反应速率
难度: 中等查看答案及解析
-
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[
].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )

A.室温下,醋酸的电离常数约为10-5
B.A点时加入氢氧化钠溶液的体积为20.00mL
C.若B点为40mL,所得溶液中:c(H+)=c(CH3COO-)+c(CH3COOH)
D.反应过程中一定存在:0.01mol•L-1+c(OH-)=c(Na+)++c(CH3COOH)
难度: 困难查看答案及解析





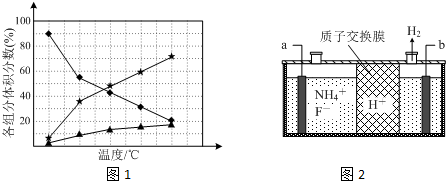
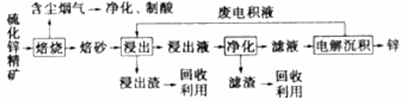





 ,请回答下列问题:
,请回答下列问题: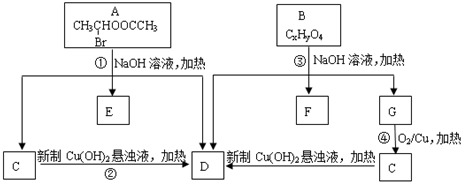

 。
。