-
化学与科学、技术、社会和环境密切相关。下列有关说法中错误的是
A. 对工业废水、生
活污水净化处理,减少污染物的排放
B.采用碳捕集和储存技术,逐步实现二氧化碳的零排放
C.工业上现在大规模采用电解熔融AlCl3制取Al
D.催化处理汽车尾气,减轻氮氧化物污染和光化学烟雾
难度: 简单查看答案及解析
-
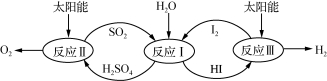
下列表达方式正确的是
A.CO2分子的比例模型
B.S2-的结构示意图:
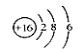
B.质子数为53,中子数为78的碘原子:78 53I
D.HClO的结构式:H-O-Cl
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,又
是吸热反应的是
A.灼热的炭与CO2反应 B.铝片与稀硫酸反应
C.Ba(OH)2·8H2O与NH4Cl的反应 D.甲烷在O2中的燃烧
难度: 简单查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热 B.滴加少量CuSO4溶液
C.加入硝酸钠固体 D.不用铁片,改用铁屑
难度: 中等查看答案及解析
-
在密闭容器中发生可逆反应4NH3+5O2
4NO+6H2O(g),以下是不同情况下的反应速率,其中最快的是
A.v(NH3)=0.03 mol/(L·S) B.v(O2)=0.08mol/(L·S)
C.v(NO)=0.06 mol/(L·S) D.v(H2O)=0.08 mol/(L·S)
难度: 中等查看答案及解析
-
利用下列实验装置能完成相应实验的是
A.装置①测定化学反应速率 B.装置②制取并吸收HCl
C.装置③量取8.5mL的稀硫酸 D.装置④模拟铁的腐蚀
难度: 中等查看答案及解析
-
在玻璃熔炉中,纯碱与石英反应生成Na2SiO3和CO2。下列说法正确的是
A.该反应是氧化还原反应 B.微粒的半径:r(Si)>r(Na)
C.Na2CO3中含有离子键和共价键 D.硅酸
的酸性强于碳酸
难度: 中等查看答案及解析
-
下列分子中,既含有σ键又含有π键的是
A. CH4 B.NH3 C.CO2 D.F2
难度: 简单查看答案及解析
-
X、Y、Z、R、W是原子序数依次增大的短周期主族元素,X是元素周期表中原子半径最小的元素。X与Z同主族,Y与R同主族,R最外层电子数是电子层数的2倍。下列叙述正确的是
A. 原子半径:W>R>Z B. W的最高价氧化物对应的水化物酸性比R的强
C. W与X形成的是离子化合物 D. R的气态氢化物的热稳定性比Y的强
难度: 中等查看答案及解析
-
镁-次氯酸盐电池的工作原理如图,该电池反应为:
Mg+ClO-+H20=Mg(0H)2+Cl-。下列有关说法正确的是
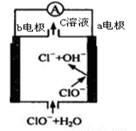
A.电池工作时,正极a附近的pH将不断增大
B.电池工作时,C溶液中的溶质是MgCl2
C.负极反应式:ClO- +2e- +H20 = Cl- +20H-
D.b电极发生还原反应,每转移0.2mol电子,理论上生成0.1 mol Cl-
难度: 困难查看答案及解析
-
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
A.原电池反应均是自发的氧化还原反应
B.氢氧燃料电池工作时氢气在正极被
氧化
C.氢氧燃料电池是将热能转变为电能的装置
D.铅蓄电池在放电
过程中,负极质量减小,正极质量增加
难度: 中等查看答案及解析
-
过氧乙酸(CH3COOOH)有强氧化性,用于物体表面、皮肤、果蔬、环境的消
毒,其制备反应为:CH3COOH+H2O2
CH3COOOH+H2O,下列有关说法正确的是
A.增大压强可加
快该反应速率 B.加入合适的催化剂可提高该反应速率
C.1mol CH3COOH含有7molσ键 D.H2O2是含有非极性键的离子化合物
难度: 中等查看答案及解析
-
下列叙述正确的是
A.原子晶体中,共价键的键能越大,熔沸点越高
B.分子晶体中,分子间作用力越
大,该分子越稳定
C.金属阳离子只能与阴离子构成晶体
D.金属晶体的熔点一定比分子晶体的高
难度: 简单查看答案及解析
-
下列各项叙述中,正确的是
A.分子晶体中不一定存在分子间作用力
B.价电子排布为4s24p1的元素位于第四周期第ⅠA族,是S区元素
C.已知金属钛的晶胞是面心立方结构(如图),则钛晶体1个晶胞中钛原子数为4个

D.水是一种非常稳定的化合物,这是由于氢键所导致
难度: 中等查看答案及解析
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A. 第一电离能:X一定大于Y
B. 气态氢化物的稳定性:HmY大于HnX
C. 最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性
D. X和Y形成化合物时,X显负价,Y显正价
难度: 中等查看答案及解析
-
已知热化学方程式:2H2(g)+O2(g)===2H2O(g)ΔH1=-483.6kJ/mol
则对于热化学方程式:2H2O(l)===2H2(g)+O2(g)ΔH2=QkJ/mol
下列说法正确的是
A.热化学方程式中化学计量数表示分子个数 B.Q = 483.6
C.Q > 483.6 D.Q < 483.6
难度: 简单查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.已知HCl和NaOH反应的中和热ΔH =-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热ΔH =-2×57.3 kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的ΔH = +(2×28
3.0)kJ·mol-1
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g);ΔH <0的化学反应下列叙述不正确的是

A.反应过程中能量关系可用如图表示
B.若将该反应设计成原电池锌为负极
C.ΔH的值与反应方程式的计量系数无关
D.若将其设计为原电池当有32.5g锌溶解时,正极放出气体一定为11.2L
难度: 中等查看答案及解析