-
节能减排关系人类的生存环境,请从我做起。下列措施不属于“节能减排”的是
A.及时关灯、关空调、关水龙头,节水、节电
B.使用天然气热水器取代电热水器
C.自2008年6月1日起,实行塑料购物袋有偿使用
D.研制开发燃料电池汽车,减少机动车尾气污染
难度: 中等查看答案及解析
-
下列是某学生自己总结的一些规律,其中正确的是
A.氧化物不可能是还原产物,只可能是氧化产物
B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
D.饱和溶液一定比不饱和溶液的浓度大
难度: 中等查看答案及解析
-
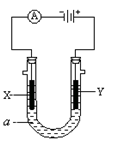
下列各组离子在相应的条件下可以大量共存的是
A.在碱性溶液中:CO32—、K+、C1—、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3—、Mg2+、Na+、SO42—
C.在c(H+)/c(OH—)==1×10—12的溶液中:NH4+、Ca2+、C1—、K+
D.在中性溶液中:Fe3+、Na+、SCN—、C1—
难度: 中等查看答案及解析
-
已知2KClO3+I2=2KIO3+Cl2,下列对此反应的说法不正确的是
A.氧化产物与还原产物的物质的量比为2︰1
B.若在标准状况下产生11.2 LCl2,转移电子的物质的量为1mol
C.上述反应说明:I2的还原性强于Cl2
D.上述反应属于置换反应
难度: 中等查看答案及解析
-
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为(已知:还原性I->Fe2+>Br->Cl-)
A.7∶1 B.7∶2 C.7∶3 D.7∶4
难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是
A.往碳酸钡中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++4OH-=AlO2-+2H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
关于下列图示的说法中正确的是
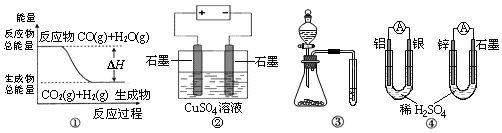
A.图①表示CO(g)+H2O(g)
CO2(g)+H2(g)是放热反应
B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1︰1
C.图③实验装置可一次而又科学准确的完成比较Cl2、Br2、I2单质氧化性强弱的实验
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
难度: 中等查看答案及解析
-
设NA为阿佛加德罗常数,下列叙述中正确的
A.标准状况下,22.4LCO2和O2混合气体中含有的氧原子数为NA
B.0.1mol Fe在0.1mol C12中充分燃烧,转移的电子数为0.3NA
C.2mol SO2和1mol O2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数为2NA
D.将0.1mol Cl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA
难度: 中等查看答案及解析
-
对相同质量的SO2和SO3来说,下列关系正确的是
①含氧原子个数比为2:3 ②含硫原子个数比为1:1
③含硫元素质量比为5: 4 ④含氧元素质量比为5:6
A.①② B.①②③④ C.①②③ D.③④
难度: 中等查看答案及解析
-
往含0.2mol KOH和0.1mol Ca(OH)2的溶液中持续地通入CO2气体,当通入气体的体积为6.72L(标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n和通入CO2的体积V的关系示意图正确的是(气体的溶解和离子的水解忽略)
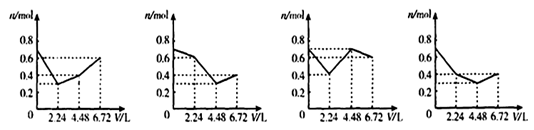
难度: 中等查看答案及解析
-
关于容量瓶的四种叙述:①是一种容积精确的仪器;②不宜贮存溶液;
③不能用来加热;④使用之前要检验是否漏水。这些叙述正确的是:
A.①②③④ B.②③ C.①②④ D.②③④
难度: 中等查看答案及解析
-
实验室里需用480 mL 0.1 mol/L的硫酸铜溶液,现选取进行配制,以下操作正确的是
A.480 mL容量瓶,称取7.68 g硫酸铜,加入500 mL水
B.500 mL容量瓶,称取12.0 g胆矾配成500 mL溶液
C.480 mL容量瓶,称取8.0 g硫酸铜,加入500 mL水
D.500 mL容量瓶,称取12.5 g胆矾配成500 mL溶液
难度: 中等查看答案及解析
-
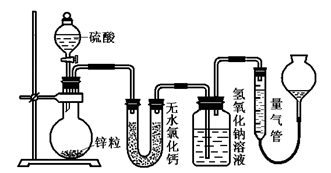
甲烷燃料电池(电解质溶液是KOH溶液)的总反应为:
CH4+2KOH+2O2 = K2CO3 + 3H2O。 下列有关的说法中不正确的是
A.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
B.该燃料电池在使用过程中电解质溶液的浓度和性质均发生变化
C.负极反应式:CH4+3H2O-8e-=CO32-+7H+
D.正极反应式:2O2+4H2O+8e-=8OH-
难度: 中等查看答案及解析
-
下列实验操作正确的是
编号
实验
操作
A
观察钠与水反应
的现象
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中
B
配制一定物质的量浓度的氯化钾溶液
准确称取一定质量的氯化钾固体,放入到1000mL的容量瓶中,加水1000mL溶解,振荡摇匀。
C
稀释浓硫酸
将蒸馏水沿烧杯内壁慢慢注入盛浓硫酸的烧杯中,并用玻璃棒不断搅拌,使产生的热量不断散失
D
取出分液漏斗中
的上层液体
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体从分液漏斗上口倒出
难度: 中等查看答案及解析
-
在密闭容器中,对于可逆反应A+3B
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
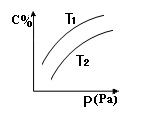
A.A一定为气体
B.B一定为气体
C.该反应是放热反应
D.若正反应方向△H <0,则T1>T 2
难度: 中等查看答案及解析
-
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,起始时容器体积均为VL,发生如下反应并达到平衡(X、Y状态未知):2X(?) + Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间Ⅰ>Ⅱ
D.平衡时Ⅰ容器的体积小于VL
难度: 中等查看答案及解析