-
2016年是门捷列夫诞生182周年,门捷列夫在化学史上的贡献是
A. 发现了电子 B. 提出了杂化轨道理论
C. 提出了元素周期律 D. 发现了能量最低原理
难度: 中等查看答案及解析
-
已知下列元素原子的最外层电子排布式,其中不能表示该元素一定为主族元素的是
A. 3s23p3 B. 4s2 C. 4s24p1 D. 3s23p5
难度: 中等查看答案及解析
-
下列化学式能真实表示物质分子组成的是
A. CO B. SiO2 C. KCl D. NaOH
难度: 中等查看答案及解析
-
下列分子中,属于含极性键的非极性分子的是
A. CH4 B. H2S C. C60 D. HCl
难度: 中等查看答案及解析
-
下列分子或离子中,立体构型不是平面三角形的是
A. CO32- B. NH3 C. BF3 D. SO3
难度: 困难查看答案及解析
-
我国科学家首次拍摄到水分子团簇的空间取向图像(模型如图)。下列关于水的说法不正确的是
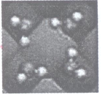
A. 水是极性分子 B. 水分子间存在氢键
C. 水分子是V形结构 D. 水分子内存在二键
难度: 中等查看答案及解析
-
下列有关电子云和原子轨道的说法正确的是
A. 原子核外的电子象云雾一样笼罩在原子核周围,故称电子云
B. s亚层的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C. p亚层的原子轨道呈纺锤形,随着电子层数的增加,p亚层原子轨道也在增多
D. s、p电子原子轨道的平均半径随电子层的增大而增大
难度: 中等查看答案及解析
-
对于排布在2s轨道上的电子,不能确定的是
A. 电子所在的电子层 B. 电子的自旋方向
C. 电子云的形状 D. 电子云的伸展方向
难度: 中等查看答案及解析
-
下列各组微粒中,互为等电子体的是
A. H3O+和OH- B. SO42-和PO43- C. NO3-和NO2- D. CH3+和NH4+
难度: 中等查看答案及解析
-
下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是
A.SiO2和SO2 B.NaCl和HCl
C.CO2和H2O D.CH4和KCl
难度: 简单查看答案及解析
-
钒在周期表中属于的区、周期和族分别为
A. ds区、第三周期、IIIB族 B. d区、第四周期、VB族
C. ds区、第三周期、VB族 D. d区、第四周期、IB族
难度: 中等查看答案及解析
-
下列有关元素周期表及元素周期律的说法错误的是
A. N能层的能级数最多为3个
B. Cu元素在元素周期表的ds区
C. F元素在同周期中电负性最大
D. 根据对角线规则,铍和铝的化学性质具有相似性
难度: 简单查看答案及解析
-
元素X和元素Y位于第二周期,其中X的原子最外层中具有最多的未成对电子,Y的原子只有两种形状的电子云,且两种形状的电子云的电子数相等,则由x、y组成的微粒中,不可能存在的是
A. X2Y5 B. XY42- C. XY2- D. XY3-
难度: 中等查看答案及解析
-
下列关于化合物A(结构简式如图)的叙述中正确的是

A. 分子中只有极性键
B. 该分子中三种元素的电负性:H>C>O
C. 分子中有σ键和兀键
D. 该分子在水中的溶解度小于甲烷的
难度: 中等查看答案及解析
-
下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
A. NH4Cl+NaOH=NaCl+NH3↑+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3↑
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=4NaOH+O2↑
难度: 困难查看答案及解析
-
W、X、Y、Z为原子序数依次增大的短周期主族元素,且原子核外L层的电子数分别为O、5、8、8,其最外层电子数之和为18。下列说法正确的是
A. XW3为分子晶体 B. 第一电离能:Y>X
C. 化合物WZ难溶于水 D. 由Y与Z形成的所有化合物均满足8电子稳定结构
难度: 困难查看答案及解析
-
由短周期前10号元素组成的物质T和X,存在如图所示的转化关系。X不稳定,易分解。下列有关说法正确的是
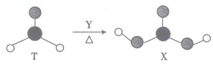
A. T分子中只含有极性键,X分子中既含有极性键又含有非极性键
B. 等物质的量的T、X分子中含有二键的数目均为NA
C. T、X分子中的
原子分别采用sp2杂化和sP3杂化
D. 为使该转化成功进行,Y可以是酸性KMnO4溶液
难度: 困难查看答案及解析
-
X、Y、Z三种液体的近似pH如图,下列判断正确的是
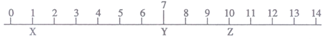
A. X可能是醋酸钠溶液 B. Y可能是90℃时的纯水
C. Y一定是正盐溶液 D. Z可使甲基橙试液变黄
难度: 中等查看答案及解析
-
醋酸被广泛用于工农业生产及食品加工中,下列有关醋酸的叙述中不正确的是
A. CH3COOH中C原子的杂化轨道类型有sp3、sp2
B. 每个CH3COOH分子中含有6个σ键
C. CH3COOH易溶于水的原因是能与水分子形成氢键
D. CH3COOH 分子中既含有极性键又含有非极性键
难度: 中等查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层电子结构都符合相应稀有气体原子的最外层电子结构,则下列有关说法中不正确的是 ( )
A.NH5中既有离子键又有共价键
B.NH5的熔沸点高于NH3
C.1 mol NH5中含有5 mol N—H键
D.将固体A投入少量水中,可生成H2和NH3·H2O
难度: 中等查看答案及解析
-
下列有关说法正确的是
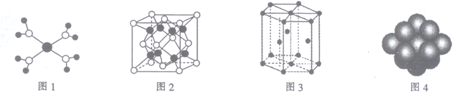
A. 水合铜离子的模型如图1所示,1个水合铜离子中含有4个配位键
B. K2O晶体的晶胞如图2所示,每个K2O晶胞平均占有8个O2-
C. 金属Zn中Zn原子堆积模型如图3所示,空间利用率为68%
D. 金属Cu中Cu原子堆积模型如图4所示,为面心立方最密堆积,每个Cu原子的配位数均为8
难度: 中等查看答案及解析
-
我国早期研制的PEM低压电解臭氧发生器的结构如图。在电解槽里,最中间的是固体电解质聚合膜,膜两边分别是多孔的阳极和多孔的阴极,纯水从两边进人阳极水箱和阴极水箱。下列说法不正确的是
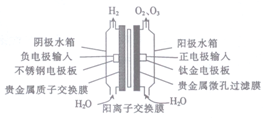
A. 在阳极室发生的反应有2H2O-4e-=4H++O2↑、3H2O-6e-=6H++O3↑
B. 通电时,H+向阴极室移动
C. 相同条件下O2与O3的体积之和小于H2的体积
D. 若用食盐水代替纯水,则对产物成分没有影响
难度: 困难查看答案及解析
-
常温下,将0.1mol·L-1的CH3COONa 溶液与0.1mol·L-1的HCl溶液混合至中性,下列叙述不正确的是
A. 加入的CH3COONa 溶液体积更大
B. c(OH-)=c(H+)
C. c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-)
D. c(Na+)+c(H+)=c(OH-)+ c(CH3COO-)+ c(Cl-)
难度: 困难查看答案及解析
-
用石墨电极a和石墨电极 电解NaNO3稀溶液的装置如图所示。通电后在两电极附近分别滴加几滴紫色石蕊试液。下列说法不正确的是
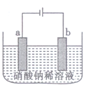
A. a电极逸出气体的体积大于b电极的
B. 溶液中的阴离子移向b电极
C. a电极附近溶液呈蓝色,b电极附近溶液呈红色
D. 若将a电极改为铜电极,b电极不变,则通电后a电极无气体逸出
难度: 中等查看答案及解析
-
已知:p(Ba2+)=-lgc(Ba2+), p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-。某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是
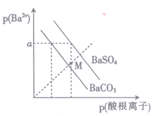
A. p(Ba2+)=a时,溶液中c(SO42-)>c(CO32-)
B. M点对应的溶液中有BaCO3 沉淀生成
C. 由图可知该温度下:Ksp(BaSO4)<Ksp(BaCO3)
D. BaSO4 沉淀不能转化为BaCO3 沉淀
难度: 困难查看答案及解析
 ;
;