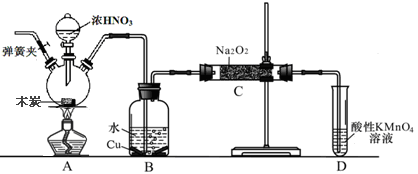
-
下列说法中不正确的是( )
A.含SO2的烟气可用石灰乳吸收后再排放,以减少对空气污染
B.汽车尾气、工业排放、建筑扬尘、垃圾焚烧等都是造成雾霾天气的主要原因
C.绿色化学的核心是对环境产生的污染进行治理
D.PM2.5由于颗粒小,在空气中存在时间长,对人体健康危害大
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,7.8gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA
B.在标准状况下,22.4LCl2和HCl的混合气体中含有的分子总数为2×6.02×1023
C.含1molFeCl3的饱和溶液滴入沸水中得到胶体数目为NA
D.标准状况下,Na2O2与足量的CO2反应生成2.24LO2,转移电子数为0.4NA
难度: 中等查看答案及解析
-
将20gM物质、5gN物质、9gP物质混合加热发生化学变化,经充分反应后的混合物中含有5gM物质、20gP物质还含有一种新物质Q,若M、N、P、Q的相对分子质量分别为30、20、44、18,它们之间发生反应的化学方程式是( )
A.M+N=P+Q B.M+2N=2P+Q
C.2M+N=2P+Q D.2M+N=P+2Q
难度: 中等查看答案及解析
-
下列溶液中物质的量浓度肯定是1mol/L的是( )
A.将40gNaOH固体溶解于1L水中
B.将22.4L氯化氢气体溶于水配成1L溶液
C.将1L10mol/L浓盐酸与10L水混合
D.10gNaOH固体溶解在水中配成250mL溶液
难度: 困难查看答案及解析
-
下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是( )
A.K+、Ca2+、Cl-、NO3- B.K+、Na+、Br-、SiO32-
C.H+、Fe2+、SO42-、Cl2 D.K+、Ag+、NH3∙H2O、NO3-
难度: 中等查看答案及解析
-
氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于阴影3区域的是( )

A.Cl2+2NaI=2NaCl+I2 B.NH4HCO3
NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 D.Fe2O3+3CO
2Fe+3CO2
难度: 中等查看答案及解析
-
下列关于金属性质的叙述中正确的是( )
A.钠与氧气反应时,产物是由O2的用量决定的
B.铝箔在空气中受热可以熔化且会发生剧烈燃烧
C.金属与非金属发生反应时,被氧化的一定是金属
D.铁丝不论在空气中还是纯氧中都不会燃烧
难度: 中等查看答案及解析
-
做实验时不小心使皮肤上沾上了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:MnO4-+C2O42-+H+=CO2↑+Mn2++__。下列有关叙述正确的是( )
A.发生还原反应的是C2O42-
B.该离子方程式右侧横线上的产物是OH-
C.10molH+参加反应时,电子转移5mol
D.该反应的氧化剂为KMnO4
难度: 困难查看答案及解析
-
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是( )

A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中一定含有SO42-和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.反应最后形成的溶液中含有的溶质只有Na2SO4
难度: 极难查看答案及解析
-
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比为( )
A.1:1 B.2:1 C.3:1 D.1:3
难度: 简单查看答案及解析
-
将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀的物质的量与通入CO2的体积之间的关系可表示为( )
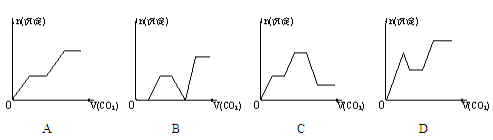
难度: 困难查看答案及解析
-
将氯水分别滴入下列溶液中,由实验现象得出的结论正确的是( )
选项
氯水滴入下列溶液中
实验现象
结论
A
滴有KSCN的FeCl2溶液
变红
Cl2具有还原性
B
滴有酚酞的NaOH溶液
褪色
Cl2具有酸性
C
紫色石蕊溶液
先变红后褪色
Cl2具有漂白性
D
淀粉—KI溶液
变蓝色
Cl2具有氧化性
难度: 中等查看答案及解析
-
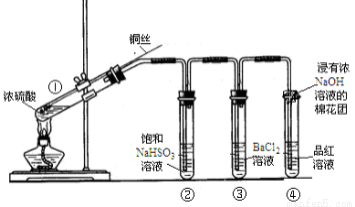
某实验过程如图所示,则图③试管中的现象是( )
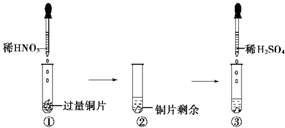
A.铜片溶解,产生无色气体,该气体遇空气变为红棕色
B.铜片溶解,产生无色气体,该气体遇到空气不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.无明显现象,因稀硫酸不与铜反应
难度: 中等查看答案及解析
-
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X.
Y
Z
①
NaOH溶液
Al(OH)3
稀硫酸
②
KOH溶液
SiO2
浓盐酸
③
O2
N2
H2
④
FeCl3溶液
Cu
浓硝酸
A.①③ B.①④ C.②④ D.②③
难度: 中等查看答案及解析
-
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
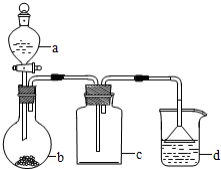
选项
a中的物质
b中的物质
c中的物质
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
难度: 困难查看答案及解析
-
已知:①2KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O
②K2Cr2O7+14HCl→2KCl+2CrCl3+3Cl2↑+7H2O
③MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
其中,KMnO4和一般浓度的盐酸反应,K2Cr2O7需和较浓的盐酸(大于6mol∙L-1)反应,MnO2需和浓盐酸反应(大于8mol∙L-1)反应。
根据以上信息,下列叙述不正确的是
A.上述各反应均既属于氧化还原反应,有属于离子反应
B.氧化性:KMnO4>K2Cr2O7>Cl2>MnO2
C.盐酸的浓度越大,Cl-的还原性越强
D.每生成1molCl2,上述各反应转移的电子数均为2NA(NA为阿伏加德罗常数的值)
难度: 极难查看答案及解析