-
化学与能源开发、环境保护、生产生活等密切相关。下列说法正确的是
A.开发利用可燃冰是缓解能源紧缺的唯一途径
B.将废电池深埋,可以避免其中的重金属污染
C.“地沟油”对人体的危害极大,严禁用作食用油
D.食品保鲜膜、食品袋的主要成分都是聚氯乙烯
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.氢氧化钠的电子式:
B.质子数为53、中子数为78的碘原子:
C.水分子比例模型:
D.对硝基甲苯的结构简式:

难度: 简单查看答案及解析
-
下列有关物质的性质或应用的说法正确的是
A.一定条件下,镁和铁的单质与水反应都有氢气生成
B.二氧化硫有漂白、杀菌性能,可在食品加工中大量使用
C.二氧化硅是半导体材料,可将太阳能直接转化为电能
D.二氧化锰有较强的氧化性,可作H2O2分解的氧化剂
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(Fe3+)=0.1 mol·L-1的溶液中:H+、Al3+、Cl-、SCN-
B.pH=12的澄清溶液中:K+、Na+、CO32-、SO42-
C.加入铝粉能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42-
D.通入足量CO2后的溶液中:Na+、C6H5O-、CH3COO-、HCO3-
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是
A.元素Y和元素Z的最高正化合价相同
B.单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z)
C.气态氢化物的热稳定性顺序为:X<Y<Z
D.元素W的最高价氧化物对应水化物的酸性最强
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.用惰性电极电解饱和食盐水:2Cl-+ 2H+
H2↑ + C12↑
B.向氯化铝溶液中通入过量氨气:4NH3 + Al3++ 2H2O=AlO2-+ 4NH4+
C.用双氧水和稀硫酸处理印刷电路板:Cu + H2O2 + 2H+=Cu2+ + 2H2O
D.足量氢氧化钙溶液与碳酸氢镁溶液反应:Ca2+ + OH-+ HCO3-=CaCO3↓+ H2O
难度: 简单查看答案及解析
-
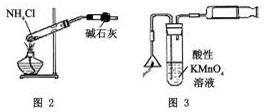
下列有关实验原理或实验操作正确的是
A.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘上称量
B.欲除去CO2中少量的SO2,将混合气通入饱和碳酸钠溶液
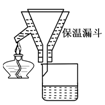
C.实验室用图2所示装置制取少量氨气
D.实验室用图3所示装置检验火柴头燃烧产生的SO2
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.0.05 mol熔融的NaHSO4中含有的阳离子数为0.10NA
B.25℃,pH=12的1 L氨水中含有的OH-数为0.01NA
C.11.2 L乙烯、乙炔的混合气体中含有的碳原子数为NA
D.5.6 g Fe和足量盐酸完全反应,转移的电子数为0.3NA
难度: 简单查看答案及解析
-
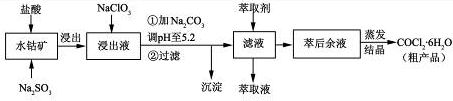
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
下列叙述正确的是
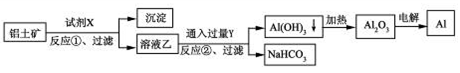
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2 + CO2 + 2H2O=Al(OH)3↓ + NaHCO3
难度: 简单查看答案及解析
-
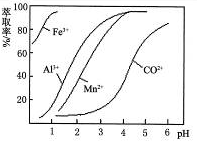
下列图示与对应的叙述相符的是

A.图4表示向某硫酸和硫酸铝混合溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液体积的关系
B.图5表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液的pH随加入盐酸体积的变化
C.图6表示t℃时稀释冰醋酸过程中溶液导电性的变化
D.根据图7可判断某可逆反应的正反应是吸热反应
难度: 简单查看答案及解析
-
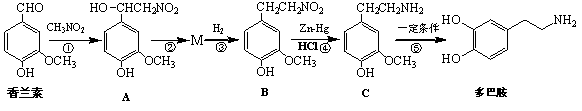
普罗帕酮为广谱高效抗心律失常药。下列说法正确的是

A.反应物X与中间体Y互为同分异构体
B.可用溴水或FeCl3溶液鉴别X和Y[
C.普罗帕酮分子中有2个手性碳原子
D.X、Y和普罗帕酮都能发生加成、水解、氧化、消去反应
难度: 简单查看答案及解析
-
下列说法正确的是
A.反应2A(g) + B(g) = 3C (s) + D(g)在一定条件下能自发进行,说明该反应的ΔH<0
B.常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.常温下,H2CO3分子不可能存在于pH=8的碱性溶液中
D.在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率
难度: 简单查看答案及解析
-
下列有关实验原理、方法和结论都正确的是
A.将蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口,有大量白烟,该无机酸一定为盐酸
B.向含少量苯酚的苯中加入适量溴水后过滤,可除去苯酚
C.向KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,说明SO2具有还原性
D.某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42-
难度: 简单查看答案及解析
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是[
A.0.1mol·L-1某二元弱酸酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
B.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:
c(Na+) = c(SO42-) >c(NH4+) >c(H+) > c(OH-)
C.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(H+)+ c(HCO3-) + c(H2CO3)
D.用0.1 mol·L-1 CH3COOH溶液滴定0.1mol·L-1 NaOH至中性时:
c(CH3COO-)+ c(CH3COOH)>c(Na+)
难度: 简单查看答案及解析
-
一定温度下,容积为2 L的甲、乙两固定容积的密闭容器中,发生反应:
2SO2(g)+O2(g)
2SO3(g)。达平衡时测得有关数据如下表。
容 器
甲
乙
反应物投入量
2 mol SO2、1 mol O2
4 mol SO3
n(SO3)/mol
1.6
a
反应物的转化率
α1
α2
下列说法正确的是
A.α1+α2>1
B.1.6<a<3.2
C.若甲中反应2 min时达到平衡,则2 min 内平均速率ν(O2)= 0.2 mol·L-1·min-1
D.甲平衡后再加入0.2 mol SO2、0.2 mol O2和0.4 mol SO3,平衡正向移动
难度: 简单查看答案及解析