-
1923年丹麦化学家布朗斯特和英国化学家劳里提出了酸碱质子理论,其定义是凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论,下列粒子既可看作酸又可看作碱的是
A. CH3COO- B. HSO3- C. OH- D. C2O42-
难度: 简单查看答案及解析
-
下列物质中属于非电解质的是
A. 氢氧化钠 B. 硫酸钡 C. 二氧化硫 D. 铜单质
难度: 简单查看答案及解析
-
下列用品的有效成分及用途对应错误的是
选项
A
B
C
D
用品




有效威分
NaCl
Na2CO3
Al(OH)3
NaClO
用途
调味品
发酵粉
抗酸药
消毒剂
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
将SO2气体通入BaCl2溶液中,无明显现象,然后再通入X气体或加入X溶液,有白色沉淀生成,X不可能是
A. NO2 B. HCl C. H2O2 D. NH3
难度: 简单查看答案及解析
-
下列物质的性质与应用对应正确的是
A. 亚硫酸钠具有还原性,可用作抗氧化剂
B. SO2具有氧化性,可用于漂白纸浆
C. 浓硫酸具有吸水性,可用于干燥氨气
D. Al2O3易溶于水,可用作冶炼金属铝
难度: 简单查看答案及解析
-
在强酸性溶液中,能大量共存的离子组是
A. Na+、K+、OH-、Cl- B. K+、Fe2+、Cl-、NO3-
C. Mg2+、Na+、SO42-、Cl- D. Na+、ClO-、SO42-、I-
难度: 简单查看答案及解析
-
在物质的分离提纯实验中,不需要用到的实验装置是
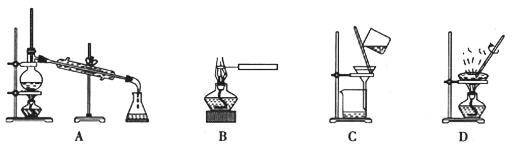
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常效的数值,下列说法不正确的是
A. 4.4g由CO2和N2O组成的混合气体中含有的原子总数为0.3NA
B. 7.8g由Na2S和Na2O2 组成的混合物中含有的阴离子数为0.1NA
C. 2.3gNa与氧气完全反应生成Na2O,转移的电子数为0.2NA
D. 5.6g铁粉在0.1mol氯气中充分燃烧,转移的电子数为0.2NA
难度: 中等查看答案及解析
-
化学概念在逻辑上存在如下关系如下所示,下列有关概念的说法正确的是
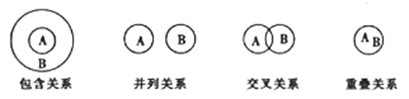
A. 化合物与电解质属于重叠关系 B. 化合反应与氧化还原反应属于包含关系
C. 溶液与胶体属于并列关系 D. 离子化合物与电解质属于交叉关系
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A. FeCl3腐蚀电路板:Fe3++Cu=Fe2++Cu2+
B. NaHCO3溶液与NaOH溶液反应:H++OH-=H2O
C. 向AlCl3溶液中加入过量的氨水:A13++4NH3·H2O=AlO2-+2H2O+4NH4+
D. 氨水和醋酸溶液混合:NH3·H2O+CH3COOH=NH4++CH3CO0-+H2O
难度: 简单查看答案及解析
-
m molCu2S与足量的稀硝酸反应,生成Cu(NO3)2、H2SO4、NO和H2O。则被还原的HNO3的物质的量为
A. 4m mol B. 10m mol C. 10m/3 mol D. 2m/3mol
难度: 简单查看答案及解析
-
用一定方法可除去下列物质中所含的少量杂质(括号内为杂质),其中所选试剂均足量且能达到除杂目的的是
A. NaCl溶液(I2):CCl4 B. Na2CO3(NaHCO3):盐酸
C. CO(SO2):Na2CO3溶液 D. FeCl2(FeCl3):Cl2
难度: 简单查看答案及解析
-
一定温度和压强下,用mg的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是

A.气球②中装的是O2
B.气球①和气球③中气体分子数相等
C.气球①和气球④中气体物质的量之比为4∶1
D.气球③和气球④中气体密度之比为2∶1
难度: 中等查看答案及解析
-
下列实验现象和结论相符的是
操作及现象
结论
A
溶液中加入盐酸,产生使澄清石灰水变浑浊的无色无味气体
溶液中一定含有CO32-
B
某溶液中加入硝酸银,产生白色沉淀
溶液中一定含有Cl-
C
用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色
溶液中有Na+,无K+
D
向某溶液中先加KSCN无明显现象,再滴氯水,溶液变红
溶液中一定含有Fe2+
难度: 中等查看答案及解析
-
下列各组物质中,满足图中所示物质转化关系且都经过一步就能实现的是
选项
X
Y
Z
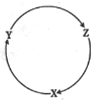
A
Na
NaOH
Na2O2
B
Fe
FeCl2
Fe(OH)2
C
NO
NO2
HNO3
D
Al
Al2O3
Al(OH)3
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
取36 g某铁矿石(只含铁的氧化物和SiO2)溶于过量的稀盐酸中,经过滤、洗染、干燥后得到5.6 g不溶物。向得到的滤液中加入足量的NaOH溶液,过滤、洗涤后将沉淀灼烧,得32 g红棕色固体。下列结论不正确的是
A. 由铁矿石转化为红棕色固体的过程中发生了氧化还原反应
B. 铁矿石溶于盐酸后得到的滤液中:n(Fe2+) :n(Fe3+)=1:1
C. 铁矿石中铁的氧化物的化学式为Fe3O4
D. 36 g该铁矿石与1mol/L的稀盐酸恰好完全反应时,消耗盐酸的体积为1L
难度: 中等查看答案及解析