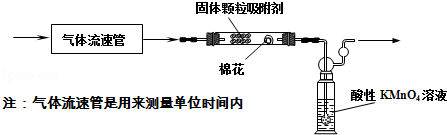
-
下列气体中,不会造成空气污染的是( )
A.N2 B.NO C.NO2 D.SO2
难度: 简单查看答案及解析
-
下列分散系不能发生丁达尔现象的是( )
A.豆浆 B.鸡蛋清溶液 C.食盐水 D.淀粉溶液
难度: 简单查看答案及解析
-
电影《闪闪的红星》中,为让被困的红军战士吃上食盐,潘冬子将浸透食盐水的棉袄裹在身上,带进山中.假如潘冬子在实验室中,欲从食盐水中提取出食盐,采用的最好方法是( )
A. 过滤 B. 萃取 C. 蒸发 D. 蒸馏
难度: 简单查看答案及解析
-
纯铁的熔点为1535℃,而在高炉中炼铁时生铁(含碳量较高的铁的合金)在1200℃左右就熔化了,这是因为( )
A.铁的纯度越高,熔点越低
B.合金的熔点比其成分物质的熔点高
C.形成了铁碳合金,所以熔点变低
D.生铁在高炉内熔化的过程中发生了化学反应
难度: 中等查看答案及解析
-
下列物质之间的反应没有明显反应现象的是( )
A.常温下,铁放入浓硝酸中
B.用玻璃棒分别蘸取浓盐酸和浓氨水并相互靠近
C.二氧化硫通入到品红溶液中
D.将氯化氢气体通入滴有酚酞的烧碱溶液中
难度: 中等查看答案及解析
-
将两粒相同大小的钠,一粒用铝箔包好为甲,另一粒为乙,将甲、乙两粒钠分别投入足量的水中,收集所得气体,气体的体积大小关系是( )
A.乙多 B.甲多 C.一样多 D.无法确定
难度: 中等查看答案及解析
-
一定量的浓硝酸与过量的铜充分反应,生成的气体是( )
A.只有NO2 B.只有NO C.NO2和NO D.NO2和H2
难度: 简单查看答案及解析
-
下列关于电解质、非电解质的说法正确的是( )
A.氯气溶于水得氯水,该溶液能导电,因此氯气是电解质
B.CaCO3饱和溶液导电能力很弱,故CaCO3是弱电解质
C.HF的水溶液中既有H+、F﹣,又有大量的HF分子,因此HF是弱电解质
D.导电能力弱的溶液肯定是弱电解质的溶液
难度: 简单查看答案及解析
-
有关硅及其化合物的叙述正确的是( )
A.二氧化硅与任何酸都不反应
B.二氧化碳通入水玻璃中能得到硅酸沉淀
C.硅的性质很稳定,能以单质形式存在于地壳中
D.二氧化硅溶于水显酸性
难度: 中等查看答案及解析
-
自然环境与人们的生活息息相关.下列有关说法中,不正确的是( )
A.废旧显示器必须回收,其主要目的是为了提取其中的贵重金属
B.生活污水中所含的氮、磷化合物是植物营养素,但会导致水体污染
C.二氧化碳和甲烷等会导致“温室效应”,从而引起全球变暖
D.雾霾天气会造成严重的交通问题,雾霾是一种胶体
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.铝粉投入到NaOH溶液中:2Al+2OH﹣═2AlO2﹣+H2↑
B.铁粉加入三氯化铁溶液中:2Fe+Fe3+═3Fe2+
C.AlCl3溶液中加入足量的氨水:Al3++3OH﹣═Al(OH)3↓
D.FeCl2溶液中加入氯水:Cl2+2Fe2+═2Fe3++2Cl﹣
难度: 中等查看答案及解析
-
在标准状况下①6.72L CH4②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是( )
A.体积②>③>①>④
B.密度②>③>①>④
C.质量②>①>③>④
D.氢原子个数①>③>②>④
难度: 中等查看答案及解析
-
同一还原剂与多种氧化剂在一起时,先与氧化性强的粒子反应,待强的反应完后,再与氧化性弱的反应,称为反应先后规律.已知氧化性:Fe3+>Cu2+,在溶有Fe2(SO4)3和CuSO4的溶液中加入铁粉,下列说法中不正确的是( )
A.若铁粉有剩余,则不溶物中一定有铜
B.若铁粉有剩余,则溶液中的金属阳离子只有Fe2+
C.若铁粉无剩余,且溶液中有Cu2+,则溶液中一定无Fe3+
D.若铁粉无剩余,且溶液中无Cu2+,则溶液中一定有Fe2+,一定无Fe3+
难度: 简单查看答案及解析
-
进行化学实验、观测实验现象,通过分析、推理得出正确的结论是化学学习的方法之一.下列对有关实验事实的解释正确的是( )
A. SO2气体使高锰酸钾溶液褪色,体现了SO2的漂白性
B. 在AgNO3的溶液中加入锌粉,能置换出银,说明AgNO3的还原性比Zn(NO3)2强
C. 浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸
D. 浓硫酸放入蔗糖中,能使蔗糖碳化,说明浓硫酸具有强氧化性
难度: 简单查看答案及解析
-
下列各图所示的实验原理、方法、装置和操作正确的是( )

难度: 简单查看答案及解析
-
下列离子检验的方法正确的是( )
A.某溶液
有白色沉淀,说明原溶液中有Cl﹣
B.某溶液
有白色沉淀,说明原溶液中有SO42﹣
C.某溶液
有蓝色沉淀,说明原溶液中有Cu2+
D.某溶液
生成无色气体,说明原溶液中有CO32﹣
难度: 简单查看答案及解析