-
FeCl3的水解方程式可写为FeCl3+3H2O
Fe(OH)3+3HCl,若提高水解程度采取的方法是
A.降低温度 B.加入少量Na2CO3
C.加入少量盐酸 D.增加FeCl3的浓度
难度: 中等查看答案及解析
-
为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH,正确的是
A.①② B.③ C.③④ D.④
难度: 中等查看答案及解析
-
同时对农作物施用含N、P、K的三种化肥,对给定的下列化肥①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4,⑤氨水,最适当的组合是
A.①③④ B.①③⑤ C.②③④ D.②③⑤
难度: 中等查看答案及解析
-
分别将下列物质:①CuSO4 ②Na2O2 ③NaCl ④Ca(HCO3)2 ⑤FeCl3投入水中,对其溶液加热蒸干,仍能得到原物质的是
A.①②③ B.①③ C.③④ D.③
难度: 中等查看答案及解析
-
把NaHCO3作为发酵粉使用时,往往加入少量的明矾,这是因为
A.明矾起催化作用 B.硫酸铝钾比碳酸氢钠更易分解
C.明矾受热分解放出气体 D.铝盐在水中能起到酸的作用
难度: 中等查看答案及解析
-
Na2S溶液中各种离子的物质的量浓度关系不正确的是
A.c(Na+)>c(S2-)>c(OH-)>c(HS-)
B.c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
C.c(Na+)=2c(HS-)+2c(S2-)+2c(H2S)
D.c(OH-)=c(H+) + c(HS-)
难度: 中等查看答案及解析
-
已知某温度下0.1mol·L-1的NaHB(强电解质)溶液中c(H+)>c(OH-),则下列有关说法或关系式一定正确的是
①HB-的水解程度小于HB-的电离程度;
②c(Na+)=0.1mol·L-1 > c(B2-);
③溶液的pH=1;
④ c(Na+)= c(HB-)+2c(B2-)+ c(OH-)
A.①② B.②③ C.②④ D.①②③
难度: 中等查看答案及解析
-
向含有AgCl(s)的饱和AgCl溶液中加水,下列叙述正确的是
A.AgCl的溶解度增大 B.AgCl的溶解度、Ksp均不变
C.Ksp(AgCl)增大 D.AgCl的溶解度、Ksp均增大
难度: 中等查看答案及解析
-
向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色。根据上述变化过程,分析此三种沉淀物的溶解度关系为
A.AgCl=AgI=Ag2S B.AgCl<AgI< Ag2S
C.AgCl>AgI> Ag2S D.AgI>AgCI> Ag2S
难度: 中等查看答案及解析
-
在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)
Ca(OH)2(aq)
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是
A.n(Ca2+)增大 B.c(Ca2+)不变
C.n(OH-)增大 D.c(OH-)减小
难度: 中等查看答案及解析
-
已知Ksp(AgCl )=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
A.AgCl不溶于水,不能转化为AgI
B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于
×10-11 mol·L-1
难度: 困难查看答案及解析
-
在原电池和电解池的电极上所发生的反应,属于氧化反应的是
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
难度: 简单查看答案及解析
-
下列叙述的方法不正确的是
A.金属的电化学腐蚀比化学腐蚀更普遍
B.用铝质铆钉铆接铁板,铁板易被腐蚀
C.钢铁在干燥空气中不易被腐蚀
D.用牺牲锌块的方法来保护船身
难度: 简单查看答案及解析
-
下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
难度: 中等查看答案及解析
-
关于如图所示装置的叙述,正确的是

A.铜是阳极,铜片上有气泡产生 B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片 D.铜离子在铜片表面被还原
难度: 中等查看答案及解析
-
关于电解NaCl水溶液,下列叙述正确的是
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
难度: 中等查看答案及解析
-
X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为
A.X>Z>Y>M B.X>Y>Z>M C.M>Z>X>Y D.X>Z>M>Y
难度: 中等查看答案及解析
-
用石墨为电极材料电解时,下列说法正确的是
A.电解NaOH溶液时,溶液浓度将减小,pH不变
B.电解H2SO4溶液时,溶液浓度将增大,pH不变
C.电解Na2SO4溶液时,溶液浓度将增大,pH不变
D.电解NaCl溶液时,溶液浓度将减小,pH不变
难度: 中等查看答案及解析
-
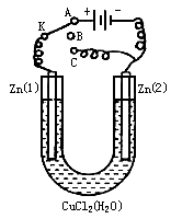
如右图所示,下列叙述正确的是
A.Y为阴极,发生还原反应 B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成 D.X为滤纸接触处变红
难度: 中等查看答案及解析
-
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH + 3O2 + 4OH—
2CO32— + 6H2O
则下列说法错误的
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:2CH3OH-12e-+16OH- = 2CO32— + 12H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
难度: 中等查看答案及解析
-
某同学为了使反应2HCl+2Ag=2AgCl↓+H2↑能进行,设计了如下图所示四个实验,你认为可行的是
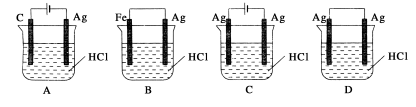
难度: 中等查看答案及解析
-
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍断续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.③④ C.②④ D.②③
难度: 中等查看答案及解析
-
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为甲烷,然后将甲烷通入以KOH为电解质的燃料电池发电。电池负极反应为
A.CH4-8e-+8OH-=CO2+6H2O B.O2+4H++4e-=2H2O
C.CH4+10OH--8e-=CO32-+7H2O D.O2+2H2O+4e-=4OH-
难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2-e-+OH-=NiO(OH)+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
难度: 中等查看答案及解析
-
pH=a的某电解质溶液中,插入两支惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是
A.NaOH B.H2SO4 C.AgNO3 D.Na2SO4
难度: 中等查看答案及解析