-
实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是
选项
实验目的
主要仪器
所用试剂
A
检验石蜡油的分解产物
硬质试管、酒精灯
石蜡油、石棉
B
鉴别葡萄糖和蔗糖
试管、酒精灯
葡萄糖溶液、蔗糖溶液、新制氢氧化铜悬浊液
C
测盐酸的浓度
滴定管、锥形瓶、烧杯
标准氢氧化钠溶液、待测盐酸溶液、石蕊溶液
D
铝热反应
试管、酒精灯
铝粉、氧化铁
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
己知烯烃X与氢气反应的热化学方程式为X(g)十H2 (g)=Y(g) △H<0,其中烃Y的键线式为“王”字,下列有关说法不正确的是
A. 烯烃X只有一种结构
B. 烯烃X的摩尔质量为126g/mol
C. 烃Y的一个氢原子被C4H9取代,所得产物有12种
D. 降温可以使该反应在较短时间内得到更多产物
难度: 困难查看答案及解析
-
标准状况下,下列说法正确的是
A. 等体积CH4和HF所含的电子数相同
B. pH=12的Na2CO3溶液中c(OH-)=10-2mol/L
C. 2.5gMg-Zn合金与足量的盐酸反应,放出的气体体积可能为2.24L
D. 由H2O2 制2.24LO2转移的电子数目为0.4NA
难度: 困难查看答案及解析
-
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是 ( )
A. 原子半径由大到小的顺序为:Y > Z > X
B. Y元素最高价氧化物对应的水化物化学式H2YO4
C. Y、Z两种元素气态氢化物中,Z的气态氢化物最稳定
D. X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2
难度: 困难查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 1.5 gCH3+含有的电子数为NA
B. 在l L 0.l mol/L氯化铝溶液中阳离子总数大于0.l NA
C. 60g SiO2和12g金刚石中各含有4NA个si—O键和4NA个C—C键
D. 标准状况下,11.2 L四氯化碳中含有的C—CI键的个数为2NA
难度: 困难查看答案及解析
-
有机物A和B只由C、H、O中的2种或3种元素组成,等物质的量的A与B完全燃烧时,消耗氧气的物质的量相等,则A与B相对分子质量之差(其中n为正数)不可能为( )
A. 8n B. 18n C. 14n D. 44n
难度: 困难查看答案及解析
-
H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)
H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法不正确的是

A. 电路中每流过2mol电子,电池内部释放316kJ热能
B. 每34gH2S参与反应,有2mol H+经质子膜进入正极区
C. 电极a为电池的负极
D. 电极b上发生的电极反应为:O2+4e
+4 H+=2H2O
难度: 困难查看答案及解析
-
甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如下图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是
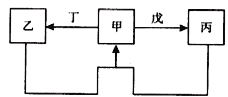
选项
假设
结论
A
甲为S
戊可能是氧气
B
甲为Al(OH)3
丁可能是氢氧化钠溶液
C
甲为Fe
丁可能是硝酸
D
甲为Na2CO3溶液
戊可能是CO2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
W、X、Y、Z是原子序数依次增大的四种短周期元素,分属于连续的四个主族,电子层数之和10,四种原子中X原子的半径最大。下列说法正确的是
A. W所在主族的元素的原子次外层电子数不可能为18
B. 四种元素有两种元素在第二周期
C. X、Y、Z的最高价氧化物对应的水化物之间能两两反应
D. 工业上获得X、Y单质的方法主要是电解其熔融的氯化物
难度: 困难查看答案及解析
-
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法不正确的是

A. 线段Ⅱ表示Fe2+的变化情况
B. 线段Ⅳ发生反应的离子方程式为:I2+5Cl2+12OH-=2IO3-+10Cl-+6H2O
C. 根据图象可计算a=6
D. 原溶液中c(Fe2+)∶c(I-)∶c(Br-)=2∶1∶3
难度: 困难查看答案及解析
-
高铁酸盐(如Na2FeO4)已经被广泛应用在水处理方面,以铁基材料为阳极,在高浓度强碱溶液中利用电解的方式可以制备高铁酸盐,装置如图。下列说法不正确的是
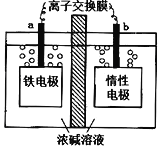
A. a为阳极,电极反应式为Fe—6e- +8OH- =FeO42- +4H2O
B. 为防止高铁酸根扩散被还原,则离子交换膜为阳离子交换膜
C. 在电解过程中溶液中的阳离子向a 极移动
D. 铁电极上有少量气体产生原因可能是4OH--4e-=O2↑+2H2O
难度: 困难查看答案及解析
-
Cl2O黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。种制取Cl2O 的装置如图所示。

已知:C12O的熔点为-116℃,沸点为3.8℃,Cl2 的沸点为-34.6℃;HgO+2Cl2=HgCl2 +Cl2O
下列说法不正确的是
A. 装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸
B. 通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险
C. 从装置⑤中逸出气体的主要成分是Cl2O
D. 装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
难度: 困难查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作及实验现象
结论
A
室温下,用pH试纸分别测定浓度为0.1 mol·L-1NaClO溶液和0.1 mol·L-1CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
B
向某溶液中滴加KSCN溶液,无明显现象,再滴加少量酸性高锰酸钾溶液,紫色褪去
溶液中含有Fe2+,不含Fe3+
C
取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,此气体能使澄清石灰水变浑浊
Na2O2已经变质
D
向浓度均为0.1 mol·L-1NaCl和Na2CrO4混合溶液中滴加0.1 mol·L-1AgNO3溶液,先生成白色的AgCl沉淀
Ksp(AgCl)<Ksp(Ag2CrO4)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
A、B、C三种常见物质中均含有同一种元素,它们之间有如图所示的转化关系(部分反应物质已略去)。下列说法不正确的是
A. 若A是一种两性氧化物,则B的水溶液可呈酸性,C的水溶液可呈碱性
B. 若A为一种金属单质时,则反应①、②、③均可为化合反应,反应④可为置换反应
C. 若A、B、C是三种不同类别的固态物质,则B可以是工业上制取A、C的原料
D. 若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液pH<7,则将C通入A溶液中,pH值先减小后增大
难度: 困难查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6LCl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO32HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
难度: 中等查看答案及解析
-
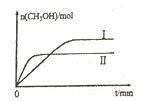
在初始温度为500℃、容积恒定为10L的三个密闭容器中,如图充料发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H=-25kJ/mol。已知乙达到平衡时气体的压强为开始时的0.55倍;乙、丙中初始反应方向不同,平衡后对应各组分的体积分数相等。下列分析正确的是( )
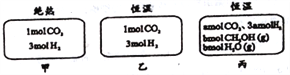
A. 刚开始反应时速率:甲>乙 B. 平衡后反应放热:甲>乙
C. 500℃下该反应平衡常数:K=3×102 D. 若a≠0,则0.9<b<l
难度: 中等查看答案及解析
-
废塑料的回收再生利用将工业垃圾变成极有价值的工业生产原料。具有不可忽略的潜在意义。利用如图所示的装置隔绝空气加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,以此探究废塑料的再利用。下列叙述正确的是
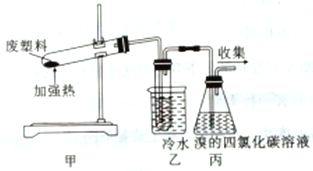
A. 聚丙烯的链节是-CH2-CH2-CH2-
B. 装置乙的试管中收集到的物质不能使酸性高锰酸钾溶液褪色
C. 装置丙中的试剂可吸收烯烃且出现溶液分层现象
D. 最后收集的气体可作燃料
难度: 困难查看答案及解析
-
H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系正确的是
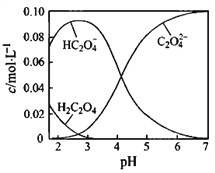
A. pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B. c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-)
C. c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+ c(HC2O4-)
D. pH=7的溶液中:c(Na+)=2c(C2O42-)
难度: 困难查看答案及解析
-
质子交换膜燃料电池(简称:PEMFC),又称固体高分子电解质燃料电池,是一种以含氢燃料与空气作用产生电力与热力的燃料电池,膜极组和集电板串联组合成一个燃料电池堆。目前,尤以氢燃料电池倍受电源研究开发人员的注目。它的结构紧凑,工作温度低(只有80℃),启动迅速,功率密度高,工作寿命长。工作原理如图,下列说法正确的是

A. 可用一氧化碳代替图中氢气形成质子交换膜燃料电池
B. B极的电极反应式为O2+4H++4e-=2H2O
C. 用该电池作为精炼铜的电源时,A极与粗铜电极相连
D. 当外电路中转移0.1mole-时,通过质子交换膜的H+数目为0.2NA
难度: 困难查看答案及解析