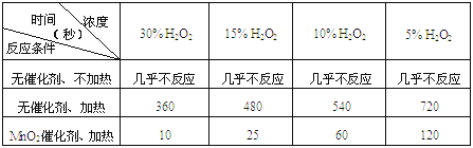
-
下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是
A.10℃ 20mL 3mol/L的盐酸溶液 B.20℃ 30mL 2mol/L的盐酸溶液
C.20℃ 20mL 2mol/L的盐酸溶液 D.20℃ 10mL 4mol/L的盐酸溶液
难度: 中等查看答案及解析
-
下列说法正确的是
A. 原电池是把电能转化为化学能的装置 B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 元素周期表中第ⅠA族全部是金属元素 D. 原电池中的阳离子向正极移动
难度: 简单查看答案及解析
-
19世纪中叶,对元素周期律有重大贡献的科学家是
A. 勒夏特列 B. 门捷列夫 C. 道尔顿 D. 拉瓦锡
难度: 简单查看答案及解析
-
下列说法中错误的是
A. 离子化合物中可能含有共价键
B. 化学键的断裂和形成是化学反应中能量变化的主要原因
C. 稀有气体元素原子的最外层都有8个电子
D. 元素周期表中金属元素和非金属元素分界线附近的元素可能用于制半导体材料
难度: 简单查看答案及解析
-
下列各物质中酸性最弱的是
A. H2SiO3 B. HClO4 C. H2SO4 D. H2CO3
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 随着核电荷数增加,碱金属单质的密度逐渐增大
B. 随着核电荷数增加,卤素单质的熔沸点逐渐降低
C. 随着核电荷数的增加,碱金属单质与水反应的剧烈程度增大
D. 随着核电荷数增加,碱金属离子的氧化性逐渐增强,卤素离子的还原性逐渐减弱
难度: 中等查看答案及解析
-
某元素气态氢化物化学式为H2R,则其最高价氧化物对应的水化物化学式为
A. H2RO3 B. H2RO4 C. HRO3 D. H3RO4
难度: 中等查看答案及解析
-
YBa2Cu8Ox(Y元素为钇)是悬浮列车中的重要超导材料,关于
Y的说法不正确的是
A. 质子数与中子数之差为50 B. 元素钇的原子序数为39
C. 原子的核外电子数是39 D.
Y和
Y是两种不同的核素,二者互为同位素
难度: 简单查看答案及解析
-
已知 2SO2+O2
2SO3为放热反应,对该反应的下列说法中正确的是
A.O2的能量一定高于SO2的能量
B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生
难度: 中等查看答案及解析
-
下列排序错误的是
A. 原子半径:Na>Mg>C>N B. 热稳定性:HI<HBr<HCl<HF
C. 最高正化合价:Si<P<S<Cl D. 碱性:NaOH>Mg(OH)2>Al(OH)3>KOH
难度: 中等查看答案及解析
-
下列各个装置中能组成原电池的是:( )
A.
 B.
B. 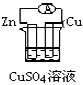 C.
C.  D.
D. 
难度: 中等查看答案及解析
-
决定化学反应速率的主要因素是
A.参加反应的物质本身的性质 B.催化剂
C.温度、压强以及反应物的接触面 D.反应物的浓度
难度: 中等查看答案及解析
-
下列化学用语正确的是
A. 硅的原子结构示意图:
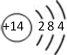 B. NH4Cl的电子式:
B. NH4Cl的电子式: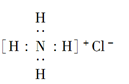
C. KCl的电子式:K
D. CO2的结构式:O-C-O
难度: 中等查看答案及解析
-
下列各组物质中既有离子键也有共价键的是
A. CaCl2 B. Na2O C. NH3 D. NH4Cl
难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是
A.锌粒与稀硫酸的反应 B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
难度: 中等查看答案及解析
-
有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是
A. D > A > B > C B. B > A > D > C C. D > B > A > C D. D > A > C > B
难度: 中等查看答案及解析
-
在一定条件下,N2和H2在密闭容器内反应合成NH3。下列说法不正确的是
A. 反应开始时,正反应速率最大,逆反应速率为零
B. 随着反应的进行,正反应速率逐渐减小,最后为零
C. 随着反应的进行,逆反应速率逐渐增大,最后不变
D. 随着反应的进行,正反应速率逐渐减小,最后不变
难度: 中等查看答案及解析
-
在反应A(g)+2B(g)===3C(g)+4D(g)中,表示该反应速率最快的是
A. v(A)=0.2 mol/(L·s) B. v(B)=0.6 mol/(L·s)
C. v(C)=0.8 mol/(L·s) D. v(D)=1 mol/(L·s)
难度: 简单查看答案及解析
-
在一定条件下,对于密闭容器中进行的反应:2SO2(g) + O2(g)
2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
A. 正、逆反应速率都等于零 B. SO2、O2、SO3的浓度相等
C. SO2、O2、SO3在容器中共存 D. SO2、O2、SO3的浓度均不再变化
难度: 简单查看答案及解析
-
同一主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱是H3XO4<H3YO4<H3ZO4,下列推断不正确的是
A. 电子层数:X>Y>Z B. 气态氢化物稳定性:XH3<YH3<ZH3
C. 原子序数:X<Y<Z D. 元素的非金属性强弱:X<Y<Z
难度: 中等查看答案及解析
-
在2 L容积不变的容器中,发生N2+3H2
2NH3的反应。现通入H2和N2发生反应,10 s内用H2表示的反应速率为0.12 mol·L-1·s-1,则10 s内消耗N2的物质的量是
A. 2.4 mol B. 0.8 mol C. 1.2 mol D. 0.4 mol
难度: 简单查看答案及解析
-
过量锌粉与一定量稀盐酸反应,为了减慢反应速率,但又不影响生成的氢气总量,可采取的措施是
A. 升高温度 B. 加入浓度较大的盐酸 C. 加入少量CuSO4 D. 加入适量的水
难度: 中等查看答案及解析
-
在一密闭容器中进行反应:N2(g)+3H2(g)
2NH3(g)。反应从正反应开始。下列说法错误的是
A. 反应开始时,正反应速率最大 B. 反应开始时,v逆(NH3)=0
C. v(H2)∶v(NH3)=3∶2时,反应达到平衡状态 D. 单位时间内,消耗n mol N2的同时生成3n mol H2 ,此时该反应达到平衡状态
难度: 中等查看答案及解析
-
在体积为2 L密闭容器中加入反应物A、B,发生如下反应:A(g)+2B(g)=3C(g)。经2 min后,A的浓度从开始时的1.0 mol·L-1 降到0.8 mol·L-1。已知反应开始时B的浓度是1.2 mol·L-1。则:2 min末B的浓度为_______________,C的物质的量为______________。2 min内,用A物质的浓度变化来表示该反应的反应速率,即v(A)=___________________。2 min内,B的转化率是___________。
难度: 中等查看答案及解析