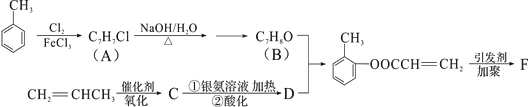
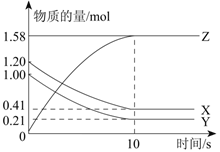
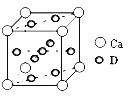
-
下列关于胶体和溶液的区别,叙述正确的是
A. 胶体带电荷,溶液不带电荷
B. 一束光线通过溶液时没有明显现象,而通过胶体时会出现明显的光路
C. 溶液中分散质可通过滤纸,胶体中分散质不能通过滤纸
D. 溶液长时间静置易产生浑浊,胶体长时间静置不产生浑浊
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=l0c2
C. pH =11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. NaHCO3溶液中有:HCO3-+H2O
CO32-+H3O+加水稀释后,H+浓度减小
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O
AlO2-+4NH4++2H2O
B. 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-
CaCO3↓+H2O
C. 碳酸钙溶于醋酸:CaCO3+2H+
Ca2++CO2↑+H2O
D. 氯化亚铁溶液中通入氯气:2Fe2++Cl2
2Fe3++2Cl-
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
A. 1mol铁与足量的氯气完全反应转移的电子数为2NA
B. 标准状况下,11.2LCCl4中含有的分子数为0.5NA
C. 常温常压下,1molCO2、CO的混合气中含有的碳原子数为NA
D. 1L1mol•L﹣1CuCl2溶液中含有的氯离子数为NA
难度: 困难查看答案及解析
-
H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) ∆H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法错误的是( )
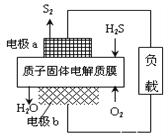
A. 电池工作时,电子从电极a经负载流向电极b
B. 实际工作中当反应生成64gS2时,电池内部释放632kJ电能
C. 电极a上发生的电极反应为:2H2S - 4e-= S2 + 4H+
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入正极区
难度: 中等查看答案及解析
-
可逆反应m A(s)+n B(g)
e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是( )
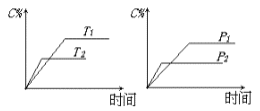
A. 达平衡后,加入催化剂则C%增大
B. 达平衡后,若升温,平衡左移
C. 化学方程式中n>e+f
D. 达平衡后,增加A的量有利于平衡向右移动
难度: 困难查看答案及解析