-
下列说法不正确的是
A.食盐既可作调味剂,也可作防腐剂
B.维生素C具有还原性,可用作食品抗氧化剂
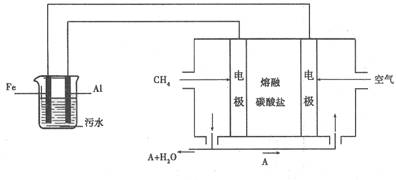
C.向含有Hg2+的废水中加入Na2S3使Hg2+转化成HgS沉淀除去
D.淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应
难度: 简单查看答案及解析
-
下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是
A.AlCl3 溶液中投入过量Na:Al3+ + 4Na+2H2O ==AlO2 - +4Na+ + 2H2 ↑
B.甲醇、氧气和氢氧化钾溶液组成的燃料电池的负极反应
CH3OH+H2O-6e-= CO2↑+6H+
C.NaClO 溶液中通入过量SO2 ClO -+SO2 + H2O == HClO + HS03 –
D.向明矾溶液中滴加Ba(OH)2 ,恰好使SO42- 沉淀完全:
2Al3++3S04 2-+ 3Ba2+ + 6OH - == 2Al(OH)3↓+ 3BaSO4↓
难度: 简单查看答案及解析
-
在密闭容器中,反应X2(g)+ Y2(g)
2XY(g);△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,图中对此过程的分析正确的是

A.图I是加入适当催化剂的变化情况 B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是升高温度的变化情况 D.图Ⅲ是增大压强的变化情况
难度: 简单查看答案及解析
-
短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比6:7,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是
A.X单质可以通过铝热法获得
B.Y的氧化物是良好的半导体材料
C.Z的氢化物比W的氢化物更稳定
D.X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
难度: 简单查看答案及解析
-
已知下列反应:
2FeCl3+2KI===2FeCl2+2KCl+I2
2FeCl2+Cl2===2FeCl3
I2+SO2+2H2O===H2SO4+2HI
判断下列物质的还原性由强到弱的顺序是
A.I->Fe2+>Cl->SO2 B.SO2>I->Fe2+>Cl-
C.Fe2+>I->Cl->SO2 D.Cl->Fe2+>SO2>I-
难度: 简单查看答案及解析
-
室温下,下列关于pH均为9、体积均为10mL的NaOH溶液和CH3COONa溶液比较的说法,正确的是
A.两种溶液中的c(Na+)相等
B.分别加热到相同温度时,CH3COONa溶液的pH小
C.分别加水稀释到100mL时,两种溶液的pH依然相等
D.两溶液中由水电离出的c(OH-)之比为10-9/10-5
难度: 简单查看答案及解析
-
美国罗氏生产的奥司他韦磷酸盐胶囊剂(商品名中国大陆称达菲·港译特敏福,台湾译为克流感)是市场上唯一的奥司他韦制剂。2009的,由于甲型H1N1在世界范围的扩散,全球掀起一般抢购达菲原风潮。奥司他韦的结构如图;下列说法正确的是
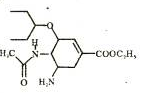
A.奥司他志是一种芳香族化合物,分子式为C18H28O4N3
B.1mol该化合物可以和3mol氢气发生加成反应
C.该化合物能发生水解反应,加成反应、氧化反应和消去反应
D.奥司他韦可以和磷酸在一定条件下制取奥司他韦磷酸盐是由于具有碱性基团氨基
难度: 简单查看答案及解析
-
化学是以实验为基础的自然科学,下列实验操作方法正确的是
①制氧气时排水法收集氧气后出现倒吸现象,应立即停止加热
②给试管中的液体加热时,可加入碎瓷片或不时移动试管,以免暴沸伤人
③分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④检查容量瓶是否漏水的方法是:向容量瓶中加水,塞好瓶塞,将容量瓶倒过来,若不 漏水,将瓶塞旋转180°,再倒过来,看是否漏水
⑤为加速固体物质的溶解常采取搅拌、加热等措施
⑥使用pH试纸测量溶液的酸碱性时,先把pH试纸用蒸馏水润湿后,再测量
⑦酒精灯在桌子上歪倒着火,立即用湿布盖上
⑧稀释浓硫酸时,将水沿器壁缓缓倒人浓硫酸中
A.①③④⑥⑧ B.①④⑤⑥⑦ C.②③④⑤⑦ D.②③⑤⑥⑧
难度: 简单查看答案及解析