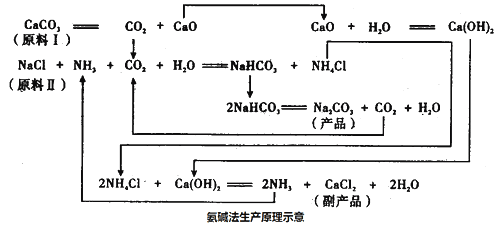
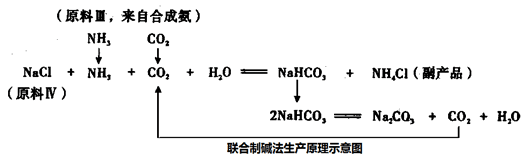
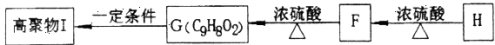-
NA为阿伏加德罗常数,下述正确的是
A.58.5g氯化钠晶体中含有NA个氯化钠分子
B.20g重水(D2O)中含有的电子数为10NA
C.标准状况下,22.4LCCl4含有NA个CCl4分子
D.120gNaHSO4晶体中阳离子和阴离子的总数为3NA
难度: 中等查看答案及解析
-
下列有关反应的离子方程式书写正确的是
A.将Na加入CuSO4溶液中:Na+Cu2+=Cu+2Na+
B.将NaHSO4溶液加入Ba(OH)2溶液中至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.向氯化铝溶液中加入足量氨水:Al3++4NH3∙H2O=AlO2-+2H2O+4NH4+
D.向Ca(OH)2溶液中通入过量SO2:SO2+ OH-=HSO3-
难度: 中等查看答案及解析
-
已知2Fe3++2I-=2Fe2++I2、Br2+2Fe2+=2Fe3++2Br-。现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是
①按Br2、Fe3+、I2的顺序氧化性逐渐减弱
②原溶液中Br-一定被氧化
③通入氯气后原溶液中的Fe2+一定被氧化
④不能确定通入氯气后的溶液中是否还存在Fe2+
⑤若取少量所得溶液,加入CCl4后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
A.①②③④ B.①③④⑤ C.②④⑤ D.①②③④⑤
难度: 困难查看答案及解析
-
下列对于实验I~IV的说法正确的是

A.实验I: 逐滴滴加盐酸时,试管中立即产生大量气泡
B.实验II:可比较氯、碳、硅三种元素的非金属性强弱
C.实验III:从饱和食盐水中提取NaCl晶体
D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
难度: 困难查看答案及解析
-
下列叙述正确有几个
①晶体中不一定存在分子间作用力,但一定存在化学键
②液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
③向Fe(NO3)2溶液中通入过量的HI,最终Fe2+被氧化生成Fe3+
④将SO2通入紫色石蕊溶液,溶液先变红,后褪色
⑤将过量的二氧化碳气体通入硅酸钠溶液中,然后加热蒸干,再在高温下充分灼烧,最后得到的固体为碳酸钠和二氧化硅
A.0个 B.1个 C.2个 D.3个
难度: 中等查看答案及解析
-
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验:

下列说法正确的是
A.无法确定原试液中是否含有Al3+、Cl-
B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C.原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
D.无法确定沉淀C的成分
难度: 极难查看答案及解析