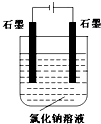
-
化学反应SO2+H2O+HNO3-H2SO4+NO经配平后,还原剂的化学计量数为( )
A.1
B.2
C.3
D.4难度: 中等查看答案及解析
-
CO、H2在一定条件下合成乙醇:2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g),正反应为放热反应.下列说法错误的是( )
A.反应物的总能量大于生成物的总能量
B.增大H2浓度可以使CO转化率达到100%
C.使用合适的催化剂、升高温度均可加大反应速率
D.反应达到平衡时,正反应和逆反应的化学反应速率相等且不为零难度: 中等查看答案及解析
-
环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的.下列环境问题与所对应的物质不相关的是( )
A.温室效应--CO2
B.光化学污染--NO2
C.酸雨--SO2
D.臭氧层破坏--CO难度: 中等查看答案及解析
-
浙江要建成资源节约型和生态保护型省份.下列措施或说法不正确的是( )
A.火力发电用煤先进行脱硫处理,积极开发风能、生物质能发电
B.用新的无害的汽油添加剂代替四乙基铅抗震剂以减少污染
C.使用太阳能热水器、沼气利用、玉米制乙醇等都涉及到生物质能的利用
D.绿色化学要求利用化学原理从源头消除污染,期望在化学反应和化学工业过程中充分利用参与反应的原料,实现零排放难度: 中等查看答案及解析
-
2012年2月新华网报道,加拿大开发出生产医用放射性同位素99 43Tc的简单方法.下列关于99 43Tc的叙述正确的是( )
A.原子序数是99
B.中子数是56
C.质量数是43
D.电子数是56难度: 中等查看答案及解析
-
下列表示物质结构的化学用语或模型正确的是( )
A.8个中子的碳原子的核素符号:12C
B.HF的电子式:
C.Cl-离子的结构示意图:
D.CH4分子的比例模型:难度: 中等查看答案及解析
-
下列关于能量转换的认识中不正确的是( )
A.白炽灯工作时电能全部转变成光能
B.煤燃烧时化学能主要转变成热能
C.绿色植物光合作用过程中太阳能转变成化学能
D.电解水生成氢气和氧气时,电能转化成化学能难度: 中等查看答案及解析
-
从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”.下列既有旧化学键断裂,又有新化学键形成的变化是( )
A.酒精溶解于水
B.一定条件下O3转化为O2
C.氢氧化钠晶体受热熔化
D.溴的挥发难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.12C和14C互为同位素
B.正丁烷(CH3CH2CH2CH3)和异丁烷()的分子式相同
C.二氧化碳和干冰互为同素异形体
D.乙醇(CH3CH2OH)与二甲醚(CH3-O-CH3)互为同分异构体难度: 中等查看答案及解析
-
下列过程中共价键被破坏的是( )
A.碘升华
B.氯化氢溶于水
C.食盐熔化
D.水结成冰难度: 中等查看答案及解析
-
下列关于浓HNO3与浓H2SO4的叙述正确的是( )
A.露置于空气中,溶液浓度均降低
B.常温下都能与铜较快反应
C.在加热时都容易分解
D.常温下都不可用铁制容器贮存难度: 中等查看答案及解析
-
下列各组物质的性质比较正确的是( )
A.酸性:HClO4>H2SO4>H3PO4
B.稳定性:H2S>HCl>HBr>HI
C.碱性:KOH<NaOH<LiOH
D.熔点:SiO2>Na>NaCl难度: 中等查看答案及解析
-
在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的数据是( )
A.υ(A)=0.6mol•L-1•s-1
B.υ(B)=0.2 mol•L-1•s-1
C.υ(C)=0.8 mol•L-1•s-1
D.υ(D)=1.0 mol•L-1•s-1难度: 中等查看答案及解析
-
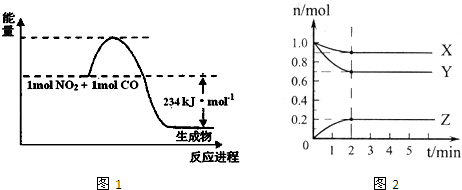
已知拆开1molH2中的化学键需要消耗436kJ能量,拆开1molO2中化学键需要消耗496kJ能量,形成水分子中1molH-O键释放463kJ能量,则下列热化学方程式正确的是( )
A.2H2+O2=2H2O△H=-484kJ•mol-1
B.2H2(g)+O2(g)=2H2O(l)△H=-484kJ•mol-1
C.2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1
D.2H2(g)+O2(g)=2H2O(g)△H=+484kJ•mol-1难度: 中等查看答案及解析
-
以下说法正确的是( )
A.白磷与金刚石一样,晶体中原子以共价键结合,形成空间网状结构
B.CO2和SiO2晶体中,化学键类型相同,晶体类型也相同
C.共价化合物可以含离子键
D.NH4Cl晶体中既含有离子键又含有共价键难度: 中等查看答案及解析
-
下列实验报告记录的实验现象正确的是( )
实验 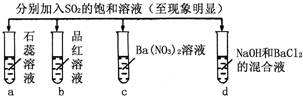
记
录a b c d A 无色 不褪色 无色溶液 无色溶液 B 红色 无色 白色沉淀 白色沉淀 C 红色 无色 无色溶液 白色沉淀 D 无色 无色 白色沉淀 无色溶液
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
为检验试管中少量白色晶体是否为铵盐,下列四位同学分别设计了四种方案,其中最好的方案是( )
A.加入1mL NaOH溶液,将湿润的蓝色石蕊试纸靠近试管口
B.加入1mL NaOH溶液,将干燥的红色石蕊试纸靠近试管口
C.加入1mL NaOH溶液,加热试管,将干燥的蓝色石蕊试纸靠近试管口
D.加入1mL NaOH溶液,加热试管,将湿润的pH试纸靠近试管口难度: 中等查看答案及解析
-
一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)⇌Z(g)△H>0.经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
A.以Y浓度变化表示的反应速率为0.0005mol•L-1•s-1
B.以X浓度变化表示的反应速率为0.0005mol•L-1•s-1
C.若单位时间内生成a mol Y的同时,生成2a mol X,则反应达到平衡状态
D.若升高温度,正反应速率增大,逆反应速率减小难度: 中等查看答案及解析
-
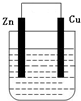
将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
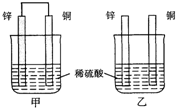
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性减小
D.甲、乙溶液均变蓝难度: 中等查看答案及解析
-
某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.3mol•L-1和0.1mol•L-1.向该混合液中加入2.56g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度是 (假设反应前后溶液体积不变)( )
A.0.15
B.0.1875
C.0.225
D.0.45难度: 中等查看答案及解析