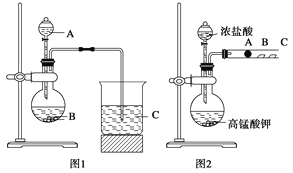
-
在恒温、恒容的密闭容器中反应A(g) B(g)+C(g);若反应物的浓度由2 mol·Lˉ1降到0.8 mol·Lˉ1需20s,那么反应物浓度由0.8 mol·Lˉ1降到0.2 mol·Lˉ1所需的时间为 ( )
A. 10s B. 小于10s C. 大于10s D. 无法判断
难度: 简单查看答案及解析
-
下列叙述不正确的是
A. 13C和14C属于同一元素,它们互为同位素
B. 1H和2H是不同的核素,它们的质子数相等
C. 14C和14N的质量数相等,它们的中子数不等
D. 6Li和7Li的电子数相等,中子数也相等
难度: 简单查看答案及解析
-
下列关于化学键的叙述中,正确的是 ( )
A. 氢键是一种特殊的共价键 B. 离子化合物中可能含有共价键
C. I2的挥发破坏了共价键 D. 非极性键只能存在双原子单质中
难度: 简单查看答案及解析
-
某元素的一种核素X的质量数为A,含N个中子,它与35Cl原子组成XClm分子,则a g XClm中所含质子的物质的量是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列各组物质的性质比较中不正确的是
A. 氧化性:F2>C12>Br2
B. 酸性:HClO4>H2SO4>H3PO4
C. 碱性:NaOH>Mg(OH)2>Al(OH)3
D. 热稳定性:SiH4>PH3>H2S
难度: 简单查看答案及解析
-
有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出,据此判断它们的活动性由强到弱的顺序是( )
A.D>C>A>B B.B>A>D>C C.D>B>A>C D.D>A>B>C
难度: 中等查看答案及解析
-
将少量的A、B两份锌粉装入试管中,分别加入足量的等浓度、等体积的稀硫酸中,同时向装A的试管中加入少量CuSO4溶液。如下图表示产生氢气的体积V与时间t的关系,其中正确的是( )
A.
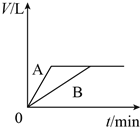 B.
B. 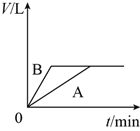
C.
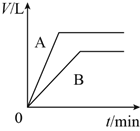 D.
D. 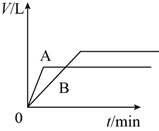
难度: 简单查看答案及解析
-
下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合形成稳定化合物的是( )
A. 10与19 B. 6与16 C. 11与17 D. 14与8
难度: 中等查看答案及解析
-
关于下图所示装置的叙述,错误的是( )
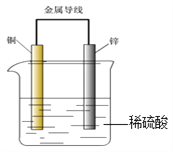
A. 锌是负极,随着放电的进行其质量逐渐减轻
B. 放电过程中氢离子移向铜极,硫酸根离子移向锌极
C. 电流从锌极经导线流向铜极
D. 锌极上发生的是氧化反应,铜极上发生的是还原反应
难度: 简单查看答案及解析
-
一定温度下,向a L密闭容器中加入2 mol NO2(g),发生如下反应:2NO2(g) 2NO(g)+O2(g),此反应达到平衡状态的标志是 ( )
A. 混合气体的密度不再变化
B. 混合气体的平均相对分子质量不再变化
C. 混合气体中NO2、NO、O2的物质的量之比为2∶2∶1
D. 单位时间内生成2n mol NO,同时消耗2n mol NO2
难度: 中等查看答案及解析
-
下列物质中含有离子键且阴离子与阳离子数目比为1:2的是 ( )
A. CaO B. Na2O2 C. KF D. NaHCO3
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. 元素周期表中有7个横行即7个周期,有18个纵行,共16个族
B. 在周期表的右上角可找到耐高温、耐腐蚀的材料
C. 因为等浓度的HI和HCl的酸性:HI>HCl,所以非金属性:I>Cl
D. 在周期表中与IIA相邻的是IA和IIIA
难度: 简单查看答案及解析
-
原子序数为z的元素R,在周期表中它位于A、B、C、D四种元素的中间,如图所示,A、B、C、D 4种元素的原子序数之和为下列数据,其中不可能是
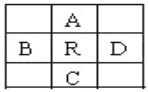
A. 4Z B. 4Z+10 C. 4Z+5 D. 4Z+14
难度: 中等查看答案及解析
-
下列反应属于放热反应的是( )
A. 氢氧化钡晶体和氯化铵晶体的反应
B. 生成物总能量低于反应物总能量的反应
C. 化学键断裂吸收的热量比化学键生成放出的热量多的反应
D. 不需要加热就能发生的反应
难度: 简单查看答案及解析
-
如图所示,两电极一为碳棒,一为铁片,若检流计的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是 ( )

A. a为负极,是铁片,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. a为正极,是碳棒,烧杯中的溶液为硫酸
D. b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
难度: 中等查看答案及解析
-
下列对非金属元素(除稀有气体外)的相关判断正确的是 ( )
(1) 非金属元素都是主族元素
(2) 单质在反应中都只能作氧化剂
(3) 氢化物常温下都是气态,所以都叫气态氢化物
(4) 氧化物常温下都可以与水反应生成酸
(5) 非金属元素R所形成的含氧酸盐(MaROb )中的R元素必定呈现正价
A. (2) (5) B. (1) (3)
C. (1) (5) D. (2) (3) (4)
难度: 简单查看答案及解析