-
生活中处处有化学,下列表述不正确的是( )
A.燃煤时加入适量的石灰石可减少二氧化硫的排放
B.用于制作集成电路板的酚醛树脂是天然高分子化合物
C.硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
D.控制工业废水和生活污水的排放可以有效地防止水体污染,改善水质难度: 中等查看答案及解析
-
在0.1mol/L的醋酸钠溶液中加入等体积的下列物质,溶液中离子浓度大小关系正确的是( )
A.水:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.0.1mol/L盐酸:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-)
C.0.1mol/L醋酸:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.0.1mol/L氢氧化钠:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)难度: 中等查看答案及解析
-
乙酸香兰酯是用于调配奶油、冰淇淋的食用香精,其合成反应的化学方程式如下:

下列叙述正确的是( )
A.该反应不属于取代反应
B.乙酸香兰酯的分子式为C10H8O4
C.FeCl3溶液可用于区别香兰素与乙酸香兰酯
D.乙酸香兰酯在足量NaOH溶液中水解得到乙酸和香兰素难度: 中等查看答案及解析
-
X、Y、Z、W四种短周期主族元素的原子序数依次增大,X在短周期中原子半径最大,Y是地壳中含量最高的金属元素,Z的最高正化合价与最低负化合价的代数和为4.下列说法正确的是( )
A.气态氢化物的稳定性:Z<W
B.X与W形成的化合物中含有共价键
C.最高价氧化物对应水化物的碱性:X<Y
D.Y的氧化物不能与X的最高价氧化物的水化物发生反应难度: 中等查看答案及解析
-
已知下述三个实验均能发生化学反应.
下列判断正确的是( )① ② ③ 将铁钉放入硫酸铜溶液中 向硫酸亚铁溶液中滴入几滴浓硝酸 将铁钉放入氯化铁溶液中
A.实验①和③中的铁钉只做还原剂
B.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
C.实验②中Fe2+既显氧化性又显还原性
D.实验③中反应的离子方程式为:Fe+Fe3+═2Fe2+难度: 中等查看答案及解析
-
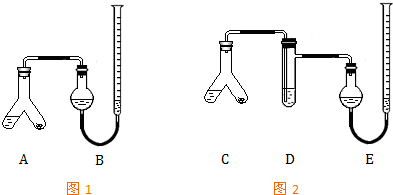
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法正确的是( )

A.a电极是阴极
B.a极区的KI最终转变为KIO3
C.阳极电极反应:4OH--4e-═2H2O+O2↑
D.电解过程中OH-从a极区通过离子交换膜c进入b极区难度: 中等查看答案及解析
-
根据下列图示的实验操作,不能够实现实验目的是( )
A目的:浓度对化学反应速率的影响 B目的:温度对化学平衡的影响 均为1 mL硫酸
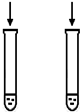
2mL Na2S2O3溶液 1mL Na2S2O3溶液
1 mL水
试剂:2mol/L 硫酸
0.1mol•L-1 Na2S2O3溶液
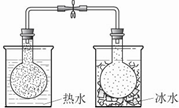
试剂:烧瓶中各充入等质量的NO2C目的:探究醋酸、碳酸、苯酚溶液的酸性强弱 D目的:鉴别碳酸钠和碳酸氢钠 醋酸 CO2
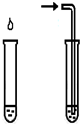
NaHCO3溶液 苯酚钠溶液
试剂:1mol/L NaHCO3溶液
1mol/L 苯酚钠溶液均为澄清石灰水
Na2CO3溶液 NaHCO3溶液
试剂:0.1mol/L Na2CO3溶液
0.1 mol/L NaHCO3溶液
A.A
B.B
C.C
D.D难度: 中等查看答案及解析