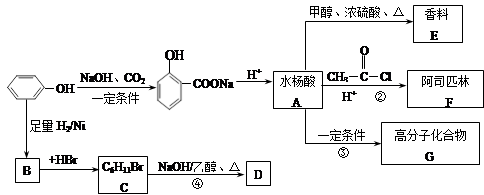
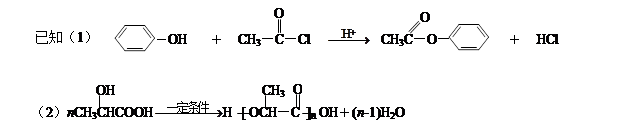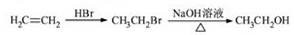-
下列说法正确的是( )
A.蔗糖和麦芽糖互为同分异构体;所有α-氨基酸都有手性碳原子
B.鸡蛋清溶液加入浓硝酸可以使蛋白质从溶液中析出,加水又溶解
C.使用聚乙烯
塑料袋比使用聚乳酸
塑料制品更环保
D.酶催化反应具有高效性、专一性、条件温和等特点
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是( )
A.中和热的热化学方程式2KOH(aq)+ H2SO4(aq)= K2SO4(aq)+2H2O(l)ΔH= -57.3 kJ/mo1
B.氢气燃烧热的热化学方程式:

C.H218O2中加入H2SO4酸化的KMnO4:5H2 18O2 + 2MnO4-+ 6H+ = 518O2↑+ 2Mn2+ + 8H2O
D.向CH2BrCOOH中加入足量的NaOH溶液并加热:CH2BrCOOH+OH- △———→CH2BrCOO-+ H2O
难度: 中等查看答案及解析
-
某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列叙述正确的是( )

A.该反应为放热反应
B.催化剂能改变反应的焓变
C.催化剂能降低反应所需活化能,增加活化分子百分数
D.逆反应的活化能大于正反应的活化能
难度: 中等查看答案及解析
-
已知:① S(单斜,s)+O2(g) = SO2(g) △H1=-297.16 kJ·mol-1
② S(正交,s)+O2(g) = SO2(g) △H2=-296.83 kJ·mol-1
③ S(单斜,s) = S(正交,s) △H3
下列说法正确的是( )
A.S(单斜)和S(正交)互为同分异构体
B.△H3= + 0.33 kJ·mol-1 ,单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s) = S(正交,s) △H3<0,正交硫比单斜硫稳定
D.S(单斜,s) = S(正交,s) △H3>0,单斜硫比正交硫稳定
难度: 中等查看答案及解析
-
一定温度下,对于反应N2+O2
2NO在密闭容器中进行,下列措施能加快反应速率的是( )
A.增大体积使压强缩小 B.恒容,充入N2
C.恒容,充入He气 D.恒压,充入He气
难度: 中等查看答案及解析
-
下列有机物的命名正确的是( )

难度: 中等查看答案及解析
-
已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡:
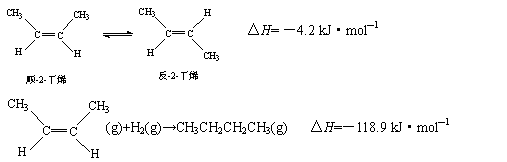
下列说法正确的是( )
A.顺-2-丁烯比反-2-丁烯稳定
B.顺-2-丁烯的燃烧热比反-2-丁烯大
C.加压和降温都有利于平衡向生成顺-2-丁烯反应方向移动
D.反-2-丁烯不能使溴水褪色
难度: 中等查看答案及解析
-
现有某有机物的结构简式如图:
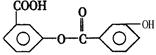 1mol该有机物充分反应后最多消耗下列物质的量,判断错误是( )
1mol该有机物充分反应后最多消耗下列物质的量,判断错误是( )A.在加热时,消耗氢氧化钠的物质的量4mol B.消耗浓溴水物质的量为3 mol
C.在催化剂条件下,加成H2的物质的量为8 mol D.在碱性下完全水解,生成一种有机物
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
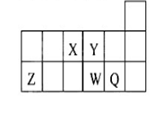
A.第一电离能和电负性: Z>W>Q
B.元素W的最高价氧化物对应的水化物的酸性比Q的强
C.离子半径X3-<Z 3+
D.元素X与元素Q二者的氢化物能化合生成离子化合物
难度: 困难查看答案及解析
-
下列溶液中,一定能大量共存的离子组是( )
A.无色溶液中:Na+、MnO4-、SO42-、K+
B.含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42-
C.加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl-
D.使蓝色石蕊试纸变红的溶液中:K+、S2-、NO3-、OH-
难度: 困难查看答案及解析
-
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
A.氨气分子是极性分子而甲烷是非极性分子
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
D.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
难度: 困难查看答案及解析
-
氰气分子式为(CN)2,结构式为N≡C—C≡N,性质与卤素相近。下列叙述错误的是( )
A.在一定条件下可与乙烯发生加成反应 B.分子中C—C大于C≡N的键长
C.不和NaOH溶液发生反应 D.氰气中σ键与π键数之比为3:4
难度: 困难查看答案及解析
-
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列错误的是( )
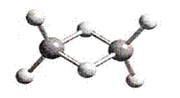
A.Al2H6在固态时所形成的晶体是分子晶体
B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6在空气中完全燃烧,产物为氧化铝和水
D.Al2H6中含有离子键和极性共价键
难度: 中等查看答案及解析
-
PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放。通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx + CO
N2 + CO2,下列关于此反应的说法中,错误的是( )
A.所涉及元素中原子半径: C>N>O
B.氧化剂与还原剂的物质的量之比为1︰1时,NOx中氮元素的化合价为+2价
C.当x = 2时,每生成1mol N2,转移电子数为4mol ,N2为氧化产物
D.等物质的量N2和CO2中,共价键的个数比为3︰4
难度: 困难查看答案及解析
-
用下图所示实验装置进行相应实验,能达到实验目的的是( )

A.装置①可用于除去Cl2中含有的少量HCl气体
B.装置②可用于制乙酸乙酯
C.装置③可证明非金属性Cl>C>Si
D.装置④向左推动针筒活塞可检验该装置的气密性
难度: 困难查看答案及解析
-
右图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )

选 项 A B C D
喷洒液 酚酞 紫色石蕊 酸性重铬酸钾 酸化的KI-淀粉
通入的气体 NH3 Cl2 CH3CH2OH(g) Cl2
预测的颜色变化 变为红色 最终褪色 无明显变化 变为蓝色
难度: 中等查看答案及解析
-
稀硫酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成H2的总量。下列操作符合的是( )
① 加Na2O2固体 ② 加H2O ③ 加H2C2O4晶体(乙二酸) ④ CH3COONa 固体
⑤ NaNO3溶液 ⑥ KCl溶液 ⑦ 加浓硫酸 ⑧ 将铁粉改加等质量的铁片
A.②④⑤⑥ B.①②⑦ C.②③⑤ D.②④⑥⑧
难度: 中等查看答案及解析
-
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是( )
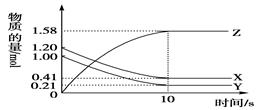
A.反应开始到10s,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10s,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y (g)
Z(g)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.3-甲基-3-乙基戊烷的一氯取代产物有5种
B.
能发生的反应类型有:加成反应、取代反应、消去反应、水解反应
C.X与Y的转化:
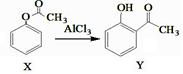 ,X与Y互为同分异构体, 可用FeCl3溶液鉴别
,X与Y互为同分异构体, 可用FeCl3溶液鉴别D.向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热,未见红色沉淀,说明淀粉未水解
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
A.恒容加入l.5mol H2和0.5mol N2,充分反应后可得到NH3分子数为NA
B.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA
C.常温常压下,22.4L Cl2与足量的铁粉反应,转移的电子数为2NA
D.标准状况下,22.4L的CH3CHO中含有的分子数为NA
难度: 困难查看答案及解析
-
镁铝合金5.1g完全溶于过量的热浓硝酸中,反应中共产生11.2 L NO2(标准状况),若在反应后溶液中加入足量的氨水溶液,则生成沉淀质量为( )
A.13.6 g B.7.8g C.5.8g D.4 g
难度: 中等查看答案及解析