-
关于生活中的化学问题,下列说法错误的是
A. 地球上的绝大多数金属元素是以化合态形式存在
B. 铜盐溶液都有毒,这主要是由于铜离子能使蛋白质变性
C. 普通玻璃以纯碱、石灰石、石英砂为主要原料制得
D. SO2气体通入氯水中可以增强氯水溶液的漂白性
难度: 中等查看答案及解析
-
分子式C8H10O的芳香醇分子数目为
A. 3 B. 4 C. 5 D. 6
难度: 中等查看答案及解析
-
下列关于有机物的来源、结构与性质说法正确的是
A. 甲烷是正四面体结构,性质活泼,常温下能与强酸、强碱发生剧烈反应
B. 乙烯是通过石油裂解得到的,属于不饱和烃
C. 苯与氢气、液溴、浓硝酸的反应类型相同
D. 乙酸又名醋酸,其官能团是醚基,可以与乙醇发生反应生成乙酸乙酯
难度: 中等查看答案及解析
-
有X、Y、Z三种原子序数逐渐增大的主族元素,它们分别处于不同短周期,其中Y是自然界中形成化合物种类最多的元素,Z元素在地壳中的含量是同周期主族元素中最高的。则下列说法错误的是
A. X与其它元素之间只能形成共价键
B. Z元素的最高价氧化物是玻璃的主要成分,其常温下就能与强碱发生反应
C. 非金属性Y强于Z
D. 三种元素中X的原子半径最小
难度: 中等查看答案及解析
-
下列说法正确的是
A. 实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→萃取
B. 不能通过“玻璃棒蘸取某溶液做焰色反应实验时火焰呈黄色”说明该溶液中含钠元素
C. 配制浓硫酸、浓硝酸的混酸时,应将浓硝酸沿玻璃棒缓慢注入浓硫酸中
D. 测氯水的pH时,可用干燥洁净的玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
难度: 中等查看答案及解析
-
下列反应中,相关示意图错误的是
A
B
C
D
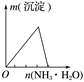
将二氧化硫通入到一定量氯水中
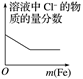
将氨水滴入到一定量氯化铝溶液中
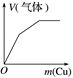
将铜粉加入到一定量浓硝酸中
将铁粉加入到一定量氯化铁溶液中
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
利用如图装置进行实验,甲乙两池均为1 mol•L—1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓度差电池,电流计指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是
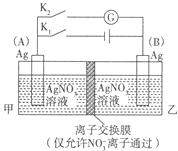
A.闭合K1,断开K2后,A电极增重
B.闭合K1,断开K2后,乙池溶液浓度上升
C.断开K1,闭合K2后,NO3— 向B电极移动
D.断开K1,闭合K2后,A电极发生氧化反应
难度: 困难查看答案及解析
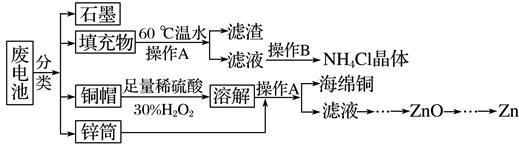
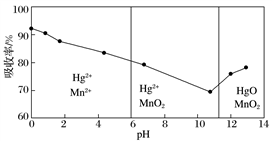
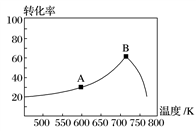
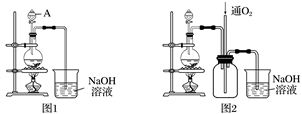
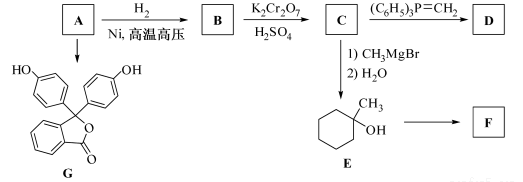

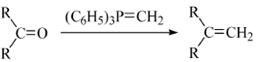 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)