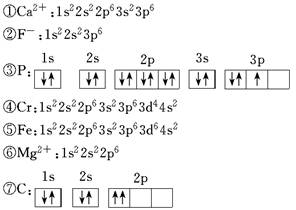
-
下列说法错误的是( )
A.1.5g CH3+中含有的电子数为0.8NA
B.Cu元素在元素周期表的ds区
C.s轨道呈圆形,p轨道呈哑铃形
D.DNA中的碱基互补配对是通过氢键来实现的
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3③1s22s22p3④1s22s22p5。则下列有关比较中正确的是( )
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>①>③=②
难度: 中等查看答案及解析
-
短周期主族元素A、B形成AB3型分子,下列有关叙述正确的是( )
A.若A、B为同一周期元素,则AB3分子一定为平面正三角形
B.若AB3分子中的价电子个数为24个,则AB3分子为平面正三角形
C.若为A、B为同一主族元素,,则AB3分子一定为三角锥形
D.若AB3分子为三角锥形,则AB3分子一定为NH3
难度: 中等查看答案及解析
-
根据键能数据估算CH4 (g)+4F2 (g) =CF4+4HF(g)的反应热ΔH为( )
化学键
C—H
C—F
H—F
F—F
键能/(kJ/mol)
414
489
565
155
A.–1940 kJ · mol-1 B.1940 kJ · mol-1
C.–485 kJ · mol-1 D.485 kJ · mol-1
难度: 中等查看答案及解析
-
短周期元素X、Y、Z和W的原子序数依次增大。X原子的最外层电子数是内层电子数的2倍,Y与X同主族,Z和W原子中未成对电子数之比为2∶1。下列说法错误的是( )
A.XW4为非极性分子
B.Y、Z、W的最高价氧化物的水化物酸性强弱顺序是Y<Z<W
C.X、Y的最高价氧化物由固态转化为气态时,克服相同的作用力
D.XW4、YW4、ZW2分子中的中心原子均为sp3杂化
难度: 中等查看答案及解析
-
右表代表周期表中的几种短周期元素,下列说法中错误的是( )
A.C、D气态氢化物稳定性强弱和沸点高低均为C>D
B.A、B、C第一电离能的大小顺序为C>B>A
C.AD3和ED4两分子的中心原子均为sp3杂化
D.ED4分子中各原子均达8 电子结构
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 基态时相同周期的两种元素的原子所占用的能级和能层是一样的
B.基态时稀有气体元素原子的价层电子数都为8
C.基态时同种元素的原子和离子的轨道排布式一样
D.非金属元素原子的d轨道一定不填充电子或填满电子
难度: 中等查看答案及解析
-
外围电子构型为4f75d16s2元素在周期表中的位置是 ( )
A.六周期ⅢB族 B.五周期ⅢB族 C.六周期ⅦB族 D.四周期ⅦB族
难度: 中等查看答案及解析
-
应用元素周期律的有关知识,可以预测我们不知道的一些元素及其化合物的性质。下列预测中不正确的是( )
①Be的最高价氧化物的水化物可能具有两性
②H2Se是无色,有毒,比H2S稳定的气体
③At单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥B和Si的最高价氧化物的水化物均为H2XO3形式,且酸性很弱
A.①②③④ B.②④⑥ C.①③⑤ D.②④⑤
难度: 中等查看答案及解析
-
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示
意图为
,b与c形成的化合物的电子式为
。下列说法中正确的是( )
A.原子半径:b>d>a>c B.电负性:a>b>d>c
C.原子序数:d>a>c>b D.最高价含氧酸的酸性:c>d>a
难度: 中等查看答案及解析
-
具有下列电子层结构的原子,其对应元素一定属于同一周期的是( )
A.两种原子的电子层上全部都是s电子
B.3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子
C.最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子
D.原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未有电子的两种原子
难度: 中等查看答案及解析
-
现有5种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素。下列说法不正确的是( )
A.ZX3可使紫色石蕊溶液变蓝
B.X、Z、Q 3种元素可组成离子化合物或共价化合物
C.离子半径:Z<Q<W
D.X2Q2、Y2X6 2种分子中含有的电子数、化学键种类都相同
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.化合物中一定含有σ键,可能含π键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于单质分子里
D.所有原子轨道在空间都具有自己的方向性
难度: 中等查看答案及解析
-
下列分子中
键与
键数之比为3∶1的是( )
A.N2 B.C2H4 C.HCHO D.HCN
难度: 中等查看答案及解析
-
下列关于杂化轨道的叙述中,不正确的是( )
A.分子中中心原子通过SP3杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
C.乙酸分子中三种原子均以杂化轨道成键
D.N2分子中N原子没有杂化,分子中有一个σ键、2个π键
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.氢键有方向性和饱和性,属于共价键
B.分子形成氢键一定使物质的熔沸点升高
C.甲醇(CH3OH)比甲硫醇(CH3SH)熔点高,原因是甲醇分子间易形成氢键
D.H2O是一种非常稳定的化合物,这是由于氢键所致
难度: 中等查看答案及解析
-
下列各组中的物质或离子都含配位键的是( )
A.H2O、Al2Cl6 B.CO2、SO42-
C.PCl5、[Co(NH3)4Cl2]Cl D.NH4Cl、[Cu(NH3)4]SO4
难度: 中等查看答案及解析
-
下列物质晶体中,同时存在极性键、非极性键和氢键的是( )
A.CO2 B.H2O C.H2O2 D.C2H2
难度: 中等查看答案及解析
-
下列各组分子中都属于含极性键的非极性分子的是( )
A.CO2、H2S B.C2H4、CH4 C.Cl2、C2H2 D.NH3、HCl
难度: 中等查看答案及解析
-
2001年诺贝尔化学奖授予在“手性碳原子的催化氢化、氧化反应”研究领域作出贡献的美、日三位科学家。下列分子属于手性分子的是( )
A.CHFBr2 B.CH3CH2OH
C.
D.
难度: 中等查看答案及解析
-
下列各式能真实表示物质分子组成的是( )
A.CaF2 B.CCl4 C.SiO2 D.Na2O2
难度: 中等查看答案及解析
-
下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
A.SiO2和SO2 B.NaCl和HCl
C.CO2和H2O D.CH4和KCl
难度: 中等查看答案及解析
-
下列物质的熔点高低顺序,正确的是( )
A.金刚石>晶体硅>碳化硅 B.K>Na
C.HCHO<CH3OH D.NaF<NaCl<NaBr
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.分子晶体的熔点一定比金属晶体的低
B.在晶体中只要有阳离子,一定有阴离子
C.在SiO2晶体中,Si原子与Si—O键数目比为1:2
D.离子化合物中可能含有非极性共价键
难度: 中等查看答案及解析
-
固体乙醇晶体中不存在的作用力是( )
A.极性键 B.非极性键
C.离子键 D.氢键
难度: 中等查看答案及解析
-
下列物质中,属于分子晶体的是( )
①二氧化硅 ②碘 ③食盐 ④蔗糖 ⑤磷酸
A.②④⑤ B.①②④
C.②③④⑤ D.①②③⑤
难度: 中等查看答案及解析
-
如下图所示,是一种晶体的晶胞,该离子晶体的化学式为( )
A.ABC B.ABC3 C.AB2C3 D.AB3C3

难度: 中等查看答案及解析
-
实现下列变化时,需克服相同类型作用力的是( )
A.水晶和干冰的熔化 B.食盐和冰醋酸的熔化
C.液溴和液汞的汽化 D.纯碱和烧碱的熔化
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动
B.原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物的官能团
C.分子间作用力比化学键弱得多,但它对物质的熔点、沸点有较大的影响,而对溶解度无影响
D.同一元素的不同含氧酸,非羟基氧越多,该酸的酸性越强
难度: 中等查看答案及解析
-
氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为( )
A.
B.
C.
D.
难度: 中等查看答案及解析