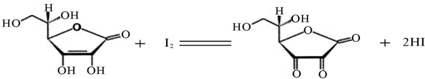-
短周期元素A、B、C、D的原子序数依次增大,它们的原子序数之和为36,且原子最外层电子数之和为14;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素.下列叙述正确的是( )
A.在地壳中,C元素的含量位于第一位
B.A、B、D三种元素形成的化合物一定是强酸
C.C元素位于元素周期表中的第3周期第ⅠA族
D.B的氢化合物一定为H2B难度: 中等查看答案及解析
-
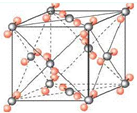
最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如右图所示,
已知断裂1mol N-N吸收167kJ热量,生成1molN≡N放出942kJ热量.根据以上信息和数据,下列说法正确的是( )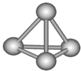
A.N4属于一种新型的化合物
B.14N原子核内的中子数为14
C.N4沸点比P4(白磷)低
D.1molN4气体转变为N2吸收882kJ热量难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值.下列说法正确的( )
A.1.5gCH3+含有的电子数为NA
B.电解精炼铜转移NA个电子时,阴极析出32g铜
C.1L0.1mol•L-1氨水溶液中所含的离子和分子总数为0.1NA
D.标准状况下,11.2L四氯化碳中含有的C-Cl键的个数为2NA难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能使甲基橙变黄的溶液中:Na+、K+、SO42-、AlO2-
B.加铝粉放出大量H2的溶液中:Na+、NH4+、SO42-、CO32-
C.c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、Cl-
D.0.1mol•L-1NaHCO3溶液中:K+、Ba2+、OH-、Cl-难度: 中等查看答案及解析
-
麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示.下列有关麦考酚酸说法正确的是( )
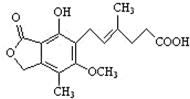
A.分子式为C17H23O6
B.不能与FeCl3溶液发生显色反应
C.在一定条件下可发生加成、取代、消去反应
D.1mol麦考酚酸最多能与3mol NaOH反应难度: 中等查看答案及解析
-
反应L(s)+aG(g)
bR(g)达到平衡时,温度和压强对该反应的影响如图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气体中G的体积分数.据此可判断( )
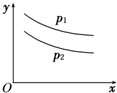
A.上述反应正方向是放热反应
B.上述反应正方向是吸热反应
C.a>b
D.a+1<b难度: 中等查看答案及解析
-
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中,正确的是( )
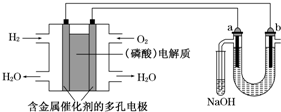
A.电池工作时,正极反应式为:O2+2H2O+4e-═4OH-
B.电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02gH2时,b极周围会产生0.04gH2难度: 中等查看答案及解析
-
将amol钠和amol铝一同放入mg水(足量)中,所得溶液的密度为dg/mL,下列说法正确的是( )
A.该溶液的物质的量浓度:
B.所得气体体积一定为44.8aL
C.该溶液的质量分数:
D.向溶液中通入过量CO2,未见白色沉淀难度: 中等查看答案及解析