-
化学与生活息息相关,下列说法错误的是( )。
A.服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒
B.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
C.漂白粉长期暴露在空气中会变质失效
D.煤炭燃烧过程安装固硫装置,可有效提高煤的利用率
难度: 简单查看答案及解析
-
青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物。屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖。青蒿素分子结构如下图,下列说法中正确的是( )。
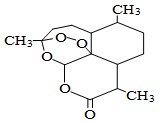
A.青蒿素能与热的NaOH溶液反应
B.青蒿素的分子式为C15H21O5
C.青蒿素分子结构中只含有极性键
D.青蒿素能使酸性KMnO4溶液褪色
难度: 简单查看答案及解析
-
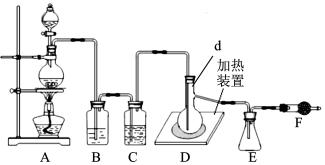
下图表示从固体混合物中分离X的2种方案,请根据方案Ⅰ与方案Ⅱ指出下列说法不合理的是( )。

A.可以选用方案Ⅰ分离NaCl中的I2
B.方案Ⅰ中X物质不可能是受热易分解的物质
C.方案Ⅱ中加入NaOH溶液可以分离出含SiO2的Fe2O3
D.方案Ⅱ中加入的也可以是能够溶解除X外的其余物质的试剂
难度: 困难查看答案及解析
-
常温下,下列关于电解质溶液的说法正确的是( )。
A.将pH=4 CH3COOH溶液加水稀释10倍,溶液中各种离子浓度均减小
B.用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至中性,
V(CH3COOH溶液) <V(NaOH溶液)
C.向0.2 mol·L-1的盐酸溶液中加入等体积0.1 mol·L-1NH3·H2O溶液:
c(Cl–)+c(OH–)=c(H+)+ c(NH3·H2O)
D.在含0.1mol NaHSO4溶液中:c(H+)=c(SO42–)+c(OH–)
难度: 中等查看答案及解析
-
用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示。下列说法正确的是( )。

A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应式为:4OH–-4e–=2H2O+O2↑
C.电解一段时间后,阴极室溶液中的pH升高
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
难度: 困难查看答案及解析
-
下列图示与对应的叙述相符的是( )。
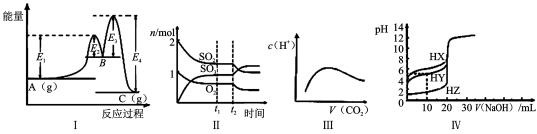
A.图Ⅰ中 可以看出反应A(g)=C(g)的△H=(E1-E4)kJ·mol-1
B.图Ⅱ表示一定条件下进行的反应2SO2+O2
2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C.图Ⅲ表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的 c(H+)变化关系
D.图Ⅳ曲线表示用0.1000 mol·L-1NaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
难度: 困难查看答案及解析
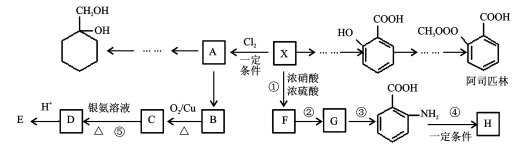
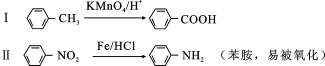
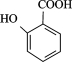 有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式
有多种同分异构体,试写出所有苯环上含有1个醛基和2个羟基,且核磁共振氢谱显示为4组峰的芳香族化合物的结构简式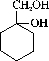 最合理的方案。在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件。
最合理的方案。在合成路线流程图的方框中填出相应的物质,并在括号注明反应条件。