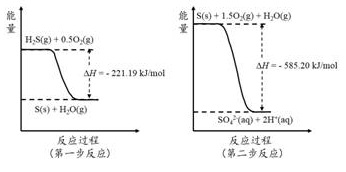
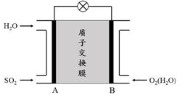
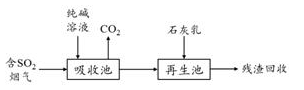
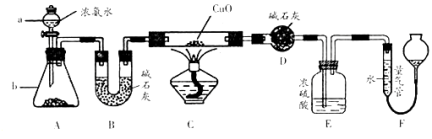
-
以NA表示阿伏伽德罗常数的值,下列说法中正确的是
A.含4molHCl的浓盐酸与足量的MnO2反应,生成的Cl2分子数目为NA;
B.标准状况下,80gSO3所含的原子数为4NA
C.46gNa与一定量O2完全反应生成Na2O和Na2O2,转移电子数为3NA
D.常温下,46gNO2和N2O4的混合体系中含有的氮氧原子数2NA
难度: 中等查看答案及解析
-
从下列实验事实所列出的相应结论不正确的是
实 验事实
结 论
①
SO2使酸性高猛酸钾溶液褪色
可证明SO2有漂白性
②
浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用硫磺粉处理洒落的金属汞
都发生了氧化还原反应
③
取少Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀,再滴加稀盐酸,沉淀不溶解
证明Na2SO3己氧化变质
④
某溶液加入稀盐酸产生能使澄清石灰水变浑浊的气体,另取该溶液滴加CaCl2溶液,有白色沉淀生成
确定该溶液存在CO32-
⑤
在某溶液中加入适量新制饱和氯水,再加入CCl4震荡,CCl4层呈橙红色
该溶液一定有Br-存在
A.①③④ B.②③⑤ C.④⑤ D.③④
难度: 中等查看答案及解析
-
将过量的SO2通入下列溶液中,最终溶液变浑浊或有沉淀生成的是
①Ca(OH)2②BaCl2③Na2SiO3④Ba(NO3)2⑤苯酚钠⑥Na2CO3
A.①②③⑥ B.②⑤⑥ C.③④⑤⑥ D.③④⑤
难度: 中等查看答案及解析
-
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),Cl-、,Br-、I-的个数比为2:3:4,向该溶液中通入Cl2使溶液中Cl-和Br-的个数之比为3 :1,则通入Cl2的物质的量与溶液中剩余Fe2+的物质的量之比为
A, 7:2 B. 7:1 C. 7:4 D. 7:3
难度: 困难查看答案及解析
-
下列各组离子在给定条件下一定能大量共存的是
A.含有大量SiO32-的溶液中:Na+、S2-、AlO2-、、SO32-
B.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
C.含有大量Al3+的溶液:Na+、NH4+、SO42-、HCO3-
D.在由水电离出的 c(H+)=1.0×10-13mol/L溶液中:NH4+、K+,、SO42-、Cl-
难度: 中等查看答案及解析
-
下列离子方程式不正确的是
A.在NaClO的溶液中通入少量的CO2:2ClO-+CO2+H2O=2HClO+CO32-
B.向碳酸氢镁溶液中加入过量的澄清石水:
Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
C.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
D.Cu溶于稀硝酸中:3Cu+8H++2NO3-=3Cu 2++2NO↑+4H2O
难度: 中等查看答案及解析
-
下列实验过程始终无明显现象的是
A. CO2气体通入Ba(NO3)2溶液中 B. NO2气体通入FeSO4溶液中
C. H2S气体通入CuSO4溶液中 D. HCl气体通入NaSiO3溶液中
难度: 中等查看答案及解析
-
下列化合物的用途叙述正确的是
A.光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材枓主要娃SiO2
B.水玻璃可用作防火剂或防腐剂
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D.SO2可用来漂白纸浆、毛、丝、草帽辫、增白食品等
难度: 中等查看答案及解析
-
向盛有Cl2的六个集气瓶甲,乙、丙、丁、戊、己中各注入下列液体中的一种,经过震荡, 现象如下所示,则中、乙、丙、丁、戊、己中注入的液体分别是
①AgNO3溶液②NaOH溶液③水④淀粉-KI溶液⑤FeCl2与KSCN混合液⑥NaBr溶液
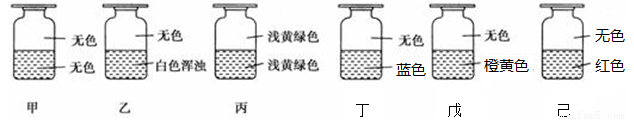
A. ②①④⑥⑤③ B. ②⑥①③④⑤ C. ②⑥③④①⑤ D. ②①③④⑥⑤
难度: 中等查看答案及解析
-
普伐他汀是—种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。下列关 于普伐他汀的描述不正确的是

A.能使酸性KMnO4溶液褪色
B.能发生加成、取代、消去反应
C.其分子式为C23H35O7
D.1mol该物质最多可与2molNaOH反应
难度: 中等查看答案及解析
-
现有易溶强电解质的混合溶液10L,其中可能含有K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下明所示,下列说法正确的是
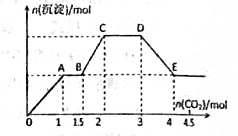
A.该溶液中能确定存在的离子是Ba2+、AlO2-、NH4+
B.肯定不存在的离子是SO42-、OH-
C.若不能确定的离子中至少还存在着一种阳离子,则该离子的最小浓度为0.2 mol/L
D.OA段反应的离子方程式:2 AlO2-+ CO2+3H2O=2Al(OH)3↓+CO32-
难度: 困难查看答案及解析
-
下列各组物质之间通过一步就能实现如图所示转化的是
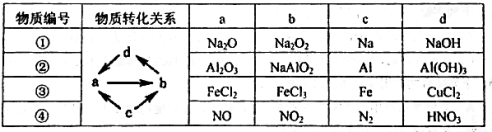
A.①② B.②③ C.②④ D.①③
难度: 中等查看答案及解析
-
下列说法正确的是
A.要除去CO2中混有少量的SO2,可用饱和的碳酸氢钠溶液
B.SO2与Cl2混合后溶于水漂白性增强
C.因常温下铁与浓硝酸不反应,故可在常温下用铁制贮罐贮运浓硝酸
D.碱石灰和无水CaCl2都可以用于干燥NH3
难度: 中等查看答案及解析
-
在一定温度下,某浓度的酸与金属锌反应生成NO2和NO,两者的物质的量之比为1: 3, 则要使I mol金属锌完全反应,反应过程中消耗HNO3的物质的量为
A.2.4 mol B.2.6 mol C.2.8 mol D.3.2 mol
难度: 困难查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(己知硝酸只被还原为NO气体)。下列分析或结果错误的是
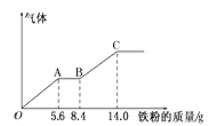
A.H2SO4浓度为2.5mol·L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.原混合酸中NO3-的物质的量为0.1mol
难度: 困难查看答案及解析
-
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子己完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体枳为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 困难查看答案及解析