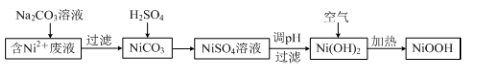
-
化学与生产、生活密切相关,下列说法正确的是( )
A.明矾作为净水剂,可以除去废水中的铜离子
B.焰火的五彩缤纷是某些金属元素化学性质的展现
C.用活性炭为蔗糖脱色和用臭氧漂白纸浆的原理相同
D.工业上以氯气和石灰乳为原料制备漂白粉
难度: 中等查看答案及解析
-
有德国重离子研究中心人工合成的第112号元素的正式名称为“Copernicium”,相应的元素符号位“Cn”。该元素的名称是为了纪念天文学家哥白尼而得名。该中心人工合成Cn的过程可表示为:7030Zn+20882Pb=277112Cn+10n
下列叙述中正确的是( )
A. Cn元素的相对原子质量为277
B. 277112Cn的原子核内中子数比质子数多53
C. 上述合成过程中属于化学变化
D. Cn元素位于元素周期表的第六周期,是副族元素
难度: 中等查看答案及解析
-
下列用品的主要成分及其用途对应不正确的是

难度: 简单查看答案及解析
-
下列描述正确的是( )
A.氯水上的标签应标注

B.乙烯的结构简式:CH2CH2
C.O2-的结构示意图:
D.BeCl2的电子式:
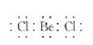
难度: 简单查看答案及解析
-
氟氧酸是较新颖的氧化剂,应用性极强,可用被氮气稀释的氟气在细冰上缓慢通过制得:F2+H2O=HOF+HF。该反应中水的作用与下列反应中水的作用相同的是
A.钠与水反应制氢气
B.过氧化钠与水反应制氧气
C.氯气与水反应制次氯酸
D.氟单质与水反应制氧气
难度: 困难查看答案及解析
-
下列关于如图所示实验的说法正确的是
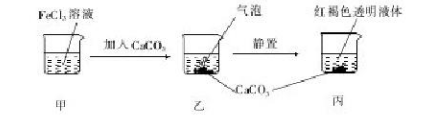
A.甲、丙两液体均可产生丁达尔现象
B.乙中产生的气泡使BaCl2溶液变浑浊
C.若忽略溶液体积的变化,则烧杯中c(Cl-)不变
D.若将CaCO3换成CaSO4,也可得到相同的实验现象
难度: 中等查看答案及解析
-
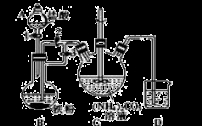
下列实验装置能达到实验目的的是( )
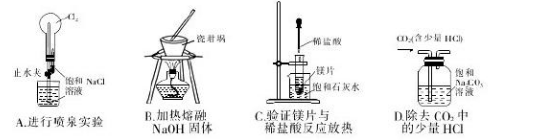
难度: 中等查看答案及解析
-
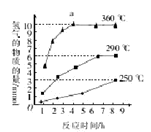
一定条件下,乙醛可发生分【解析】
CH3CHO(l)CH4+CO,已知该反应的活化能为190kJ.mol-1,在含有少量I2的溶液中,该反应的机理为:
反应Ⅰ:CH3CHO+ I2
CH3I2+HI+CO (慢)
反应Ⅱ:CH3I+HI
CH4+ I2
下列有关该反应的叙述中正确的是( )
A.反应速率与I2的浓度有关
B.HI在反应Ⅰ中是氧化产物
C.反应焓变的绝对值等于190kJ.mol-1
D.乙醛的反应速率主要取决于反应Ⅱ
难度: 困难查看答案及解析
-
NA为阿伏伽德罗常数的值,下列物质所含粒子数为0.2NA的是
A.标准状态下,2.24LCl2中含有的共价键数
B.100g质量分数为16.2%HBr溶液中的氢原子数
C.3.9gNa2O2 晶体中所含的离子总数
D.0.1molH2S和0.1molSO2混合后,体系中的硫原子数
难度: 中等查看答案及解析
-
下列各组物质中性质的变化规律排列正确的是( )
A. 酸性:HClO4>H2SO4>H3PO4>H4SiO4
B. 稳定性:HI>HBr>HCl>HF
C. 微粒半径:Al3+>Mg2+>Na+>F-
D. 碱性:Ca(OH)2>KOH>Mg(OH)2>Al(OH)3
难度: 中等查看答案及解析
-
如图R、W、X、Y、Z为五种物质,若箭头表示能进一步转化的常见反应,则其中常温下能实现图示转化关系的是( )
选项
R
W
X
Y
Z

A
Si
SiO2
H2SiO3
NaSiO3
SiCl4
B
Na
Na2O
Na2O2
Na2CO3
NaOH
C
Fe
Fe(OH)2
FeCl2
FeCl3
Fe(NO3)3
D
Al
NaAlO2
Al2(SO4)3
AlCl3
Al(NO3)3
难度: 中等查看答案及解析
-
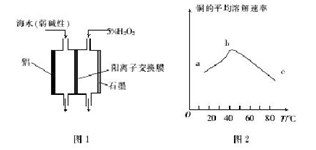
工业上用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn的工艺流程如下,下列说法正确的是
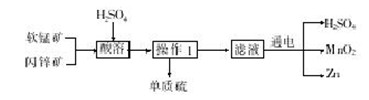
A.酸溶时,ZnS作氧化剂
B.硫酸可以循环使用
C.可用盐酸代替硫酸进行酸溶
D.MnO2和ZnS均属于盐
难度: 简单查看答案及解析
-
下列实验对应的现象及结论均正确且两者具有因果关系的是
选项
实验
现象
结论
A
SO2通入BaCl2溶液,然后滴入稀硝酸
有白色沉淀,白色沉淀不溶于稀硝酸
所得沉淀为BaSO3,后转化为BaSO4
B
浓硫酸滴入蔗糖中,并搅拌
得黑色蓬松的固体并有刺激性气味
该过程中浓硫酸仅体现吸水性和脱水性
C
向FeCl2溶液中加入Na2O2粉末
出现红褐色沉淀和无色气体
FeCl2溶液部分变质
D
向足量含有淀粉的的FeI2中滴加2滴氯水
溶液变蓝
还原性:I->Fe2+
难度: 简单查看答案及解析
-
体积为1L的某溶液可能含有Cl-、NO3-、SO42-、CO32-、NH4+、Fe2+、Al3+、Ba2+和K+,取该溶液100ml,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生的白色沉淀迅速变为灰绿色,过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。下列叙述正确的是
A.溶液中的主要离子仅为SO42-、Fe2+、NH4+
B.Cl—一定存在,且c(Cl—)=0.2mol·L-1
C.向原溶液中加入硫酸,可能有气体生成
D.CO32-、Al3+一定不存在,K+可能存在
难度: 简单查看答案及解析