-
原子序数为83的元素位于:①第5周期;②第6周期;③ⅣA族;④ⅤA族;⑤ⅡB族,其中正确的组合是( )。
A. ①④ B. ②③ C. ②④ D. ①⑤
难度: 中等查看答案及解析
-
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且 X、Y、Z相邻。X的核电荷数为Y的核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是
A. 稳定性:X的氢化物>Y的氢化物>Z的氢化物
B. 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C. YX2、M2Y都是含有极性键的极性分子
D. Z元素的最高价氧化物的水化物的化学式为HZO4
难度: 困难查看答案及解析
-
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
难度: 中等查看答案及解析
-
下列叙述中能肯定A金属比B金属金属性强的是( )
A. A原子的最外层电子数比B原子的最外层电子数少
B. A原子的电子层数比B原子的电子层数多
C. 1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多
D. 常温时,A能从水中置换出氢,而B不能
难度: 中等查看答案及解析
-
下列有关阳离子的说法中错误的是( )
①阳离子都是由一个金属原子失去电子而形成的 ②非金属原子不能形成阳离子
③阳离子的电子排布一定与稀有气体元素原子相同
④阳离子的价态不会大于其原子的最外层电子数
⑤阳离子都是稳定结构,不会再失去电子
A. ①④ B. ②④ C. ①②③ D. ①②③④⑤
难度: 简单查看答案及解析
-
关于元素周期表的叙述中不正确的是( )
A. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B. 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C. 在元素周期表的右上角可以寻找制备新型农药的元素
D. 在地球上元素的分布和它们在元素周期表中的位置有密切关系
难度: 简单查看答案及解析
-
114号元素(289Fl)是由设在杜布纳的核研究联合研究所的科学家于1998年用钙轰击钚获得,半衰期达30秒,相比之下,是超铀元素中异乎寻常的长寿核素,似乎正在证实稳定岛理论的预言。下列关于该元素的说法中不正确的是( )
A. 该元素为放射性元素
B. 该元素属于过渡元素
C. 该元素位于第7周期ⅣA族
D. 该元素的主要化合价有+4、+2
难度: 简单查看答案及解析
-
某元素最高价氧化物对应水化物的化学式为HnRO2n-2,这种元素的气态氢化物中R元素的化合价为
A. 2n-4 B. 2n-6 C. 2n-10 D. 3n-12
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 非极性键只存在于双原子单质分子里
B. 由非金属元素组成的化合物不一定是共价化合物
C. 由于H-O键比H-S 键牢固,所以水的熔沸点比H2S高
D. 在由分子构成的物质中,分子间作用力越大,该物质越稳定
难度: 简单查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外电子层结构都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数的数值)
B.NH5中既有共价键又有离子键
C.NH5的电子式为
D.NH5与水反应的化学方程式为NH5+H2O = NH3·H2O+H2↑
难度: 中等查看答案及解析
-
下列分子中所有原子都满足最外层为8电子结构的是( )
A.BF3 B.H2O C.SiCl4 D.PCl5
难度: 中等查看答案及解析
-
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl=NH3↑+HCl↑
B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 由分子构成的物质中一定存在共价键
B. 由非金属元素组成的化合物一定是共价化合物
C. 离子化合物中只含有离子键
D. 两个非金属元素原子间不可能形成离子键
难度: 简单查看答案及解析
-
电子层数相同的三种元素X、Y、Z,它们最高价氧化物对应的水化物的酸性由强到弱的顺序是:HXO4>H2YO4>H3ZO4。下列判断中不正确的是( )
A. 阴离子的半径:X>Y>Z
B. 单质的氧化性:X>Y>Z
C. 元素的非金属性:X>Y>Z
D. 气态氢化物的稳定性:X>Y>Z
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比是7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( )
A. 金属性:Y>Z
B. 氢化物的沸点:X>W
C. 离子的还原性:X>W
D. 原子及离子的半径:Z>Y>X
难度: 简单查看答案及解析
-
A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的组合是( )

①B与C均存在同素异形体;②X的种类比Y的多③沸点:A的氢化物小于C的氢化物;④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A. ①②③④ B. ②③ C. ①②④ D. ①④
难度: 中等查看答案及解析
-
现有下列短周期元素性质的数据:下列关于表中11种元素的说法正确的是
元素
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
⑪
原子半径
(10-10m)
-
0.37
0.74
0.75
0.77
0.82
0.99
1.10
1.52
1.60
1.86
最高或最低化合价
0
+1
+5
+4
+3
+7
+5
+1
+2
+1
-2
-3
-4
-1
-3
A. 上表中11种元素中形成的非金属单质都有非极性共价键
B. ②⑨处于同一周期,④⑧处于同一主族
C. 上表中11种元素中最高价氧化物对应的水化物中⑦号酸性最强
D. ⑥原子结构示意图为:
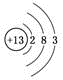
难度: 中等查看答案及解析
-
短周期元素X、Y、Z和W 的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比6∶7,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是
A. X单质不可以与CO2反应
B. Y的氧化物是良好的半导体材料
C. Z的氢化物比W的氢化物更稳定
D. X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
难度: 困难查看答案及解析
-
下列各组元素的原子间易形成共价键的是( )
原子
a
b
c
d
e
f
g
M层电子数
1
2
3
4
5
6
7
A. a和e B. a和f C. d和g D. b和g
难度: 中等查看答案及解析
-
下列粒子半径大小的比较正确的是( )
A. Na+<Mg2+<Al3+<O2- B. S2->Cl->Na+>Al3+
C. Na<Mg<Al<S D. Cs<Rb<K<Na
难度: 中等查看答案及解析