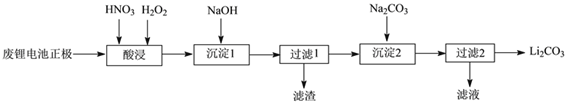
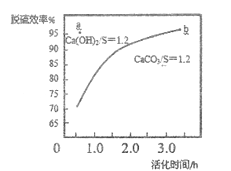
-
短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是
A. 原子半径:r(X) < r(Y) < r(Z) < r(W)
B. W的最高价氧化物的水化物是一种弱碱
C. Y的单质的氧化性比Z的强
D. X、Y、Z 三种元素可以组成共价化合物和离子化合物
难度: 中等查看答案及解析
-
2017年世界十大科技新闻中唯一化学成果:曼彻斯特大学开发出“分子机器人”,由150个碳、氢、氧和氮原子构成,在溶液中通过化学反应来“搭建”分子。下列关于“分子机器人”的说法正确的是
A. 它是一种有机高分子
B. 它与传统机器人一样可以通过电驱动
C. 它与传统机器人不同在于通过化学反应下达“搭建”指令
D. “搭建”分子只是一种物理变化
难度: 简单查看答案及解析
-
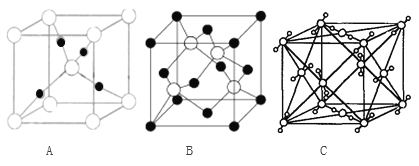
下列有关化学用语表示正确的是
A. 质子数为7、中子数为8的氮原子:
B. 氮离子(N3-)的结构示意图:
C. 氨分子的电子式:
D. 硝基苯的结构简式:
难度: 中等查看答案及解析
-
在生活用水的净化过程中,下列物质性质与用途具有对应关系的是
A. OH-可沉淀重金属离子,可用[Al2(OH)nCl6-n]m作混凝剂
B. O3具有还原性,可用于自来水的杀菌
C. 活性炭具有吸附性,可用于去除水中的异味
D. K2FeO4 易水解,可用于自来水的消毒
难度: 中等查看答案及解析
-
从海带中提取碘的实验过程中,装置和原理不能达到实验目的的是
A.
 灼烧海带 B.
灼烧海带 B. 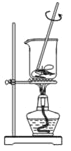 煮沸溶解 C.
煮沸溶解 C.  过滤 D.
过滤 D. 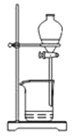 萃取分液
萃取分液难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 氯气与水反应:Cl2+H2O
H++Cl- +HClO
B. 电解饱和CuCl2溶液:Cu2+ + 2Cl-+ 2H2O
Cu(OH)2↓+H2↑+Cl2↑
C. 氢氧化钡溶液中加入硫酸铵: Ba2++ OH- +NH4++ SO42- = BaSO4↓+NH3·H2O
D. 碳酸氢钙溶液中加入足量石灰水:Ca2+ + 2HCO3-+2OH- = CaCO3↓+ 2H2O+ CO32-
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A.
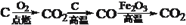
B.
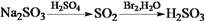
C.
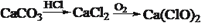
D.
难度: 中等查看答案及解析
-
2017年中国首次海域可燃冰(CH4·nH2O,密度ρ1 g·cm-3)试开采成功。若以辛烷代表汽油(密度ρ2 g·cm-3)的组成,下列说法不正确的是
① CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) ΔH1 = —a kJ·mol-1
② 2C8H18(l) + 25O2(g) =16CO2 (g) + 18H2O(l) ΔH 2 = —b kJ·mol-1
A. 可燃冰适宜保存在低温,高压的环境中
B. 1 m3可燃冰可释放出标准状况下
m3的CH4
C. 汽油的燃烧热约为0.5b kJ·mol-1
D. 1m3可燃冰释放出的甲烷燃烧放出的热量约为等体积汽油的
倍
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. 澄清透明的溶液中: Fe3+、Mg2+、SCN-、Cl-
B. c(H+)/ c(OH-) = 1×10-12的溶液中:K+、Na +、CO32-、NO3-
C. c(Fe3+) =1 mol·L-1的溶液中: Na+、NH4+、AlO2-、SO42-
D. 能使甲基橙变红的溶液中: K+、NH4+、SO42-、HCO3-
难度: 中等查看答案及解析
-
某些化学问题可用相似的示意图来表示。下列说法不正确的是
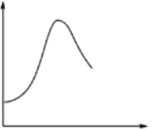
选项
横坐标
纵坐标
研究对象
A
反应过程
能量
NH4Cl和Ba(OH)2 ·8H2O反应
B
反应温度
反应速率
酶催化反应
C
HCl溶液体积
沉淀质量
0.1 mol·L-1盐酸滴加到同浓度AgNO3溶液中
D
反应时间
溶液温度
足量未打磨的镁条放在1mol·L-1H2SO4溶液中
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
表没食子儿茶素没食子酸酯(EGCG)是中国绿茶中主要的活性成份,下列说法正确的是
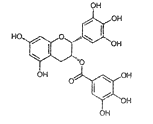
A. 分子式为C22H20O11
B. 分子只有1个手性碳原子
C. 分子易发生氧化反应,因此绿茶具有抗氧化性
D. 1mol该化合物与足量的NaOH溶液反应,最多消耗10 mol NaOH
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
溴乙烷与氢氧化钠乙醇溶液共热,生成气体通入酸性高锰酸钾溶液中,褪色
有乙烯生成
B
向试管中的浓硫酸加入铜片,盖好胶塞,导管通气入品红溶液,无明显现象
铜片未打磨
C
除去CuSO4溶液中Fe2+:先加足量H2O2,再加Cu(OH)2调溶液pH=4
Ksp[Cu(OH)2]>Ksp[Fe(OH)2]
D
将有色纸条放入盛满干燥氯气的集气瓶中,盖上玻璃片,无明显现象
氯气漂白不是Cl2分子直接作用的结果
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2 (g)+C(s)
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中I、II、III点均处于曲线上)。下列说法正确的是

A. 反应CO2(g)+c(s)
2CO(g) △H<0
B. 体系的总压强P总:P总(状态Ⅱ)
2P总(状态III)
C. 体系中c(CO):6c(CO,状态I)<c(CO,状态II)
D. 从状态I到状态III的升温过程中,每一时刻,正逆反应速率:υ逆>υ正
难度: 困难查看答案及解析

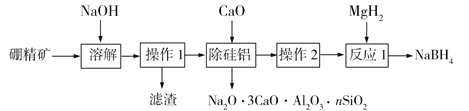
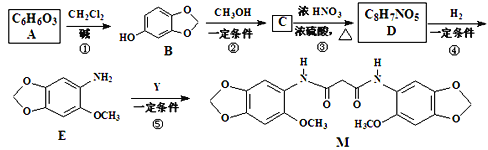
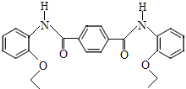 ,写出制备的合成路线流程图 (无机试剂任用,合成路线流程图示例见本题题干)______________。
,写出制备的合成路线流程图 (无机试剂任用,合成路线流程图示例见本题题干)______________。