-
化学与生产、生活密切相关,下列说法错误的是
A. 生活污水进行脱氮、脱磷处理可以减少水体富营养化
B. 食品袋中装有硅胶的小纸包的作用是防止食品受潮
C. 爆竹燃放过程中,硫燃烧直接生成三氧化硫
D. 草木灰不能与铵态氮肥混合施用
难度: 中等查看答案及解析
-
《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无砂粘土而为之”,“凡坯既成,干燥之后,则堆积窑中燃薪举火”,“浇水转釉(主要为青色),与造砖同法”。下列说法错误的是
A. 粘土是制砖瓦和水泥的主要原料
B. “燃薪举火”使粘土发生复杂的物理化学变化
C. 沙子的主要成分为硅酸盐
D. 泥坯烧制后自然冷却成红瓦,浇水冷却成青瓦
难度: 中等查看答案及解析
-
作为“血迹检测小王子”,鲁米诺反应在刑侦中扮演了重要的角色,其一种合成原理如图所示。下列有关说法正确的是
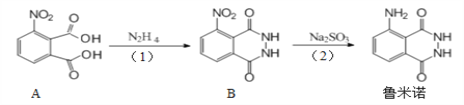
A. 鲁米诺的化学式为C8H6N3O2
B. 1 mol A分子最多可以与5 mol氢气发生加成反应
C. B中处于同一平面的原子有9个
D. (1)、(2)两步的反应类型分别为取代反应和还原反应
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,设计正确且能达到实验目的的是
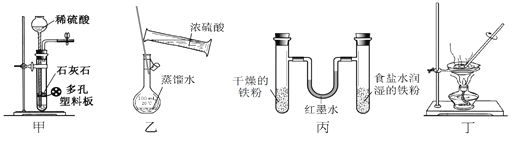
A. 甲用于实验室制取少量CO2 B. 乙用于配制一定物质的量浓度的硫酸
C. 丙用于模拟生铁的电化学腐蚀 D. 丁用于蒸干A1Cl3溶液制备无水AlC13
难度: 中等查看答案及解析
-
W是由短周期非金属主族元素X、Y按原子个数比3∶1组成的化合物。元素周期表中,Y在X的下一周期。下列叙述正确的是
A. Y的最高正价一定大于X B. Y的原子半径可能小于X
C. W只能是无机物 D. W的水溶液一定显酸性
难度: 中等查看答案及解析
-
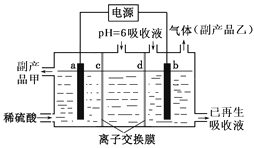
全钒液流电池装置如图,电解液在电解质储罐和电池间不断循环。下列说法错误的是
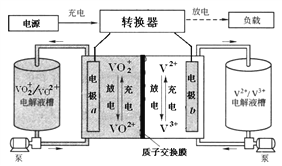
A. 充电时,氢离子通过交换膜移向右侧
B. 充电时,电源负极连接a电极
C. 放电时装置发生的总反应为:VO2++V2++2H+=VO2++V3++H2O
D. 质子交换膜可阻止VO2+与V2+直接发生反应
难度: 中等查看答案及解析
-
室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是
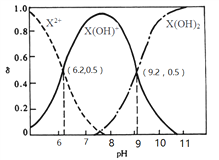
A. Kb2的数量级为10-8
B. X(OH)NO3水溶液显碱性
C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中 c(X2+)>c[X(OH)+]
D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)
难度: 中等查看答案及解析
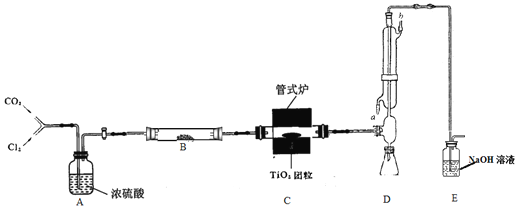
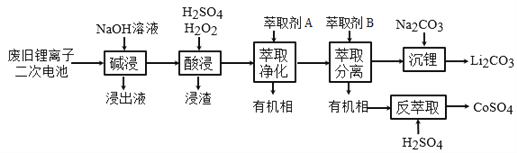
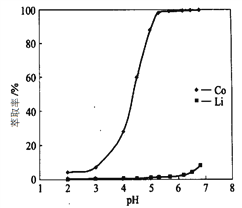
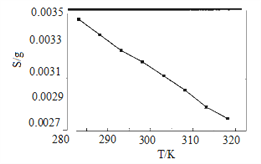
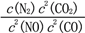 , 此反应的热化学方程式为:_________
, 此反应的热化学方程式为:_________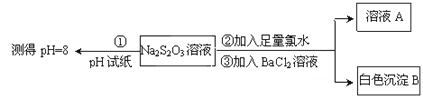

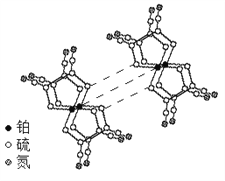
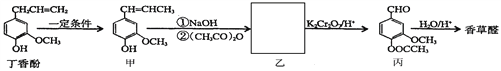
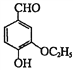 ,相对分子质量=166)的同分异构体丁是一种医药中间体,可在酸性条件下水解。丁的一种水解产物(相对分子质量=152)核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为3∶2∶2∶1,化合物丁的结构简式是______。
,相对分子质量=166)的同分异构体丁是一种医药中间体,可在酸性条件下水解。丁的一种水解产物(相对分子质量=152)核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为3∶2∶2∶1,化合物丁的结构简式是______。