-
下列离子方程式表达正确的是( )
A.用惰性电极电解熔融氯化钠:2Cl-+2H2O
Cl2↑+H2↑+2OH-
B.用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O
C.用稀氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=NO3-+NO↑+H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3-
难度: 简单查看答案及解析
-
右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是( )
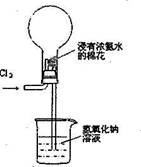
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体
难度: 简单查看答案及解析
-
下列说法正确的是( )
①漂白粉的有效成分是氯化钙和次氯酸钙 ②严格执行机动车尾气排放标准有利于防止大气污染 ③使用二氧化硫进行增白的食品会对人体健康产生损害 ④用氯气给自来水消毒可能生成对人体有害的有机氯化物
A.①②③ B.②③④
C.①③④ D.①②④
难度: 简单查看答案及解析
-
自然界中存在一种尖晶石,化学式为MgAl2O4,它晶莹剔透,非常美观,可以作为宝石。已知该尖晶石中混有一定量的Fe2O3。取该矿石粉末样品11.36 g,恰好能与200 mL一定浓度的盐酸反应,则该盐酸的浓度可能是( )
A.2.00 mol·L-1 B.2.80 mol·L-1
C.3.30 mol·L-1 D.3.50 mol·L-1
难度: 简单查看答案及解析
-
下列各组离子一定能大量共存的是( )
A.加入KSCN溶液显血红色的溶液中:Fe2+、Mg2+、Cl-、SO42-
B.能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe2+
C.常温下水电离出的c(H+)·c(OH-)=10—20的溶液中:Na+、ClO-、S2-、NH4+
D.pH=7的溶液:Fe3+、Mg2+、SO42-、Cl-
难度: 简单查看答案及解析
-
金属卤化物跟卤素化合可生成多卤化物,如:KI+I2
KI3,有关KI3的叙述中不正确的是
A.I2在KI溶液中溶解度增大是由于生成I3-离子
B.I3-在溶液中存在下列平衡I3-
I2+I-
C.KI3溶液遇淀粉不变蓝色
D.将Cl2通入KI3溶液中,I3-浓度减小
难度: 简单查看答案及解析
-
下列关于钠与水反应的说法不正确的是( )
①将小块钠投入滴有石蕊试液的水中,反应后溶液变红
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③钠在水蒸气中反应时因温度高会发生燃烧
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等
A.② B.②③
C.②③④ D.①②③④
难度: 简单查看答案及解析
-
把a g铁铝合金粉末溶于足量盐酸中,加入过量的NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁与铝的物质的量之比为( )
A.9∶8 B.8∶9
C.1∶1 D.7∶3
难度: 简单查看答案及解析
-
从矿物学资料查得一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O===7Cu2S+5FeSO4+12H2SO4,下列说法中正确的是( )
A.CuSO4是氧化剂,FeS2是还原剂 B.产物中的SO42-有一部分是氧化产物
C.Cu2S既是氧化产物又是还原产物 D.5 mol FeS2发生反应,有10 mol e-转移
难度: 简单查看答案及解析
-
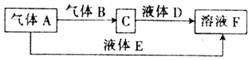
由短周期元素组成的中学常见的无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)。下列推断不正确的是( )
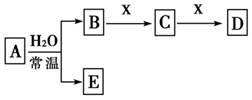
A.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+HCO3-===H2O+CO32-,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
难度: 简单查看答案及解析
-
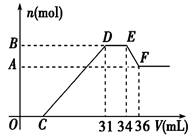
向含1 mol HCl和1 mol MgSO4的混合溶液中加入1 mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( )

难度: 简单查看答案及解析
-
向某二价金属M的M(OH)2溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体,如果计算金属M的相对原子质量,你认为还必须提供下列哪项数据( )
A.M(OH)2溶液的物质的量浓度 B.与MCO3反应的盐酸的物质的量浓度
C.MCO3的质量 D.题给条件充足,不需要再补充数据
难度: 简单查看答案及解析
-
一定温度下,有可逆反应:3Fe(s)+4H2O(g)Fe3O4 (s)+4H2O;△H>O。下列说法中正确的是( )
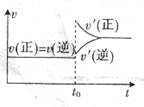
A.降低反应温度,H2O(g)的转化率增大
B.反应达到平衡后,增加Fe的量,平衡向正反应方向移动
C.反应达到平衡后,t0时增大压强,V(正)、V(逆)的变化如右图所示
D.在绝热密闭容器中,若体系温度不再发生变化,则说明该反应达到化学平衡
难度: 简单查看答案及解析
-
关于下列图示的说法中不正确的是( )

A.用图①实验装置可完成比较乙酸、碳酸、苯酚三者酸性强弱的实验
B.图②表示NOx溶于水完全转化为HNO3时,x与耗氧量y之间的关系
C.用图③装置可制得金属锰
D.图④表示可逆反应CO2 (g)+H2 (g)
CO(g)+H2O(g)的△H<O
难度: 简单查看答案及解析
-
向仅含Fe2+、I—、Br—的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )

A.线段Ⅲ代表Fe2+的变化情况
B.线段Ⅰ代表Br—的变化情况
C.a数值等于6
D.原混合溶液中n(FeBr2)=4 mol
难度: 简单查看答案及解析
-
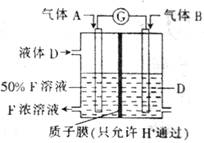
难挥发性二硫化钽(TaS2)可采用如右图装置提纯。将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2(s)+2I2(g)
TaI4(g)+S2(g)
下列说法正确的是( )

A.在不同温度区域,TaI4的量保持不变
B.在提纯过程中,I2的量不断减少
C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D.该反应的平衡常数与TaI4和S2的浓度乘积成反比
难度: 简单查看答案及解析