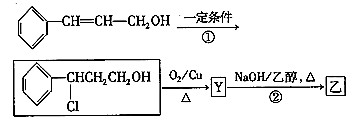
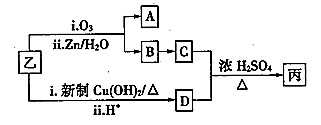
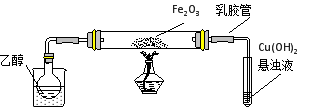
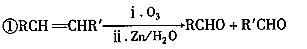-
根据下列物质的性质,判断其应用错误的是( )
A.明矾水解时产生具有吸附性的胶体粒子,可作自来水的净水剂
B.CaO能与SO2反应,可作工业废气的脱硫剂
C.浓硫酸、浓硝酸具有强氧化性,在常温下可用铁、铝制容器来盛装浓硫酸或浓硝酸
D.铜的金属活泼性比铁的弱,可在海轮外壳上焊若干铜块以减缓其腐蚀
难度: 中等查看答案及解析
-
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
A.分子式为C7H6O5
B.分子中含有两种官能团
C.可发生加成、取代和氧化反应
D.在水溶液中羟基和羧基均能电离出氢离子
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24 L戊烷所含分子数为0.1NA
B.0.3 mol NO2与水充分反应转移的电子数目为0.2NA
C.1mol Na2O2固体中所含的离子总数为4NA
D.60g SiO2晶体所含Si—O键的数目为2NA ,78 g苯含有C=C双键的数目为3NA
难度: 中等查看答案及解析
-
下列各表述与示意图一致的是( )
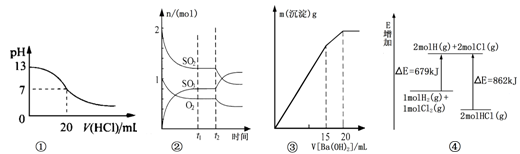
A.图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线
B.图②表示一定条件下进行的反应2SO2(g) + O2(g)
2SO3(g) ΔH < 0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积
C.图③表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全
D.图④表示化学反应H2(g)+C12(g)==2HCl(g)的能量变化,则该反应的反应热△H=﹢183 kJ/mol
难度: 中等查看答案及解析
-
六种短周期元素A、B、C、D、E、F的原子序数依次增大,A和D同族,C和F同族,B、C、D、E的离子均具有相同的电子层结构,E在同周期元素中离子半径最小。A和B、C、F均能形成共价型化合物,A和B形成的化合物Y在水中呈碱性,D和F形成的化合物在水中呈中性。下列说法错误的是( )
A.C的单质能将F单质从EF3的溶液中置换出来
B.B、D离子的半径大小是B>D
C.化合物AC的沸点比化合物AF的高
D.化合物AF与化合物Y可形成含有共价键的离子化合物
难度: 中等查看答案及解析
-
在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )
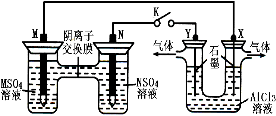
A.溶液中c(M2+)减小
B.N的电极反应式:N-2e-=N2+
C.X电极上有H2产生,发生还原反应
D.反应过程中Y电极周围生成白色胶状沉淀
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论错误的是( )
选项 实验操作 实验现象 结论
A 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 出现白色沉淀 溶液X不一定含有SO42-
B 向FeCl3+3KSCN
Fe(SCN)3+3KCl溶液平衡体系中加入少量固体KCl 体系颜色无变化] KCl不能使该平衡移动
C 向浓度均为0. 1 mol·L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 出现黄色沉淀 Ksp(AgCl)>Ksp(AgI)
D 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 均有固体析出 蛋白质均发生变性
难度: 中等查看答案及解析
-
纯碱(Na2CO3) 在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图:
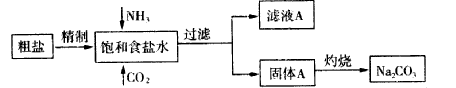
已知:向饱和食盐水中通入NH3、CO2后发生的反应为NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl。请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。
精制除杂的步骤顺序a→_______→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣;
b.加入盐酸调pH;
c.加入Ba(OH) 2溶液;
d.加入Na2CO3溶液;
e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是_____________________。
(2)灼烧固体A制Na2CO3应在_____(填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是 。对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3,使pH降低,反应的离子方程式______________________。
(3)下图装置中常用于实验室制备CO2的是_____(填字母编号);用b示意的装置制备NH3时,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂 (填试剂名称)。

(4)一种天然碱晶体成分是aNa2CO3·bNa2SO4·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实验方案。请把实验方案补充完整(仪器自选):
供选择的试剂:1.0 mol·L-1H2SO4溶液、1.0 mol·L-1BaCl2溶液、稀氨水、碱石灰、Ca(OH) 2溶液、蒸馏水
①称取m1 g一定量天然碱晶体样品,溶于适量蒸馏水中;
②_________________________________________________________________;
③_________________________________________________________________;
④计算天然碱晶体中含Na2CO3的质量分数。
难度: 极难查看答案及解析


 (5)N2O沸点(-88.49℃)比NH3沸点(-33.34℃)低,其主要原因是__________________。
(5)N2O沸点(-88.49℃)比NH3沸点(-33.34℃)低,其主要原因是__________________。