-
二氯化二硫(S2C12)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2C12是一种橙黄色液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是
A.S2C12的结构式为Cl—S—S—Cl
B.反应中SO2是还原产物,S是氧化产物
C.S2C12为含有极性键和非极性键的分子
D.反应中,生成1molSO2,转移电子为3mol
难度: 中等查看答案及解析
-
下列各组离子或分子在指定溶液中一定能大量共存的是
A.能使pH试纸呈红色的溶液:Fe2+、Mg2+、NO3-、Cl—
B.在饱和的氯水中:SO42-、NH4+、A13+、CH3CHO
C.加入A1能放出H2的溶液中:Cl—、SO32-、NO3-、HCO3-
D.
=0.1mol/L的溶液:Na+、K+、SiO32-、A1O2-
难度: 中等查看答案及解析
-
可逆反应2SO2(g)+O2(g)
2SO3(g),根据下表中的数据判断下列图像错误的是
pl(Mpa)
P2(Mpa)
400℃
99.6
99.7
500℃
96.9
97.8
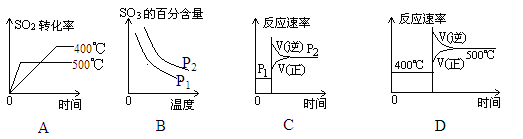
难度: 中等查看答案及解析
-
完成下列实验所选择的试剂、装置或仪器(夹持装置已略去)正确的是
A B C D
实验 用酒精提取溴水中的Br2 滴定管读数 证明非金属性强弱S>C>Si 收集C12
装置或仪器
难度: 中等查看答案及解析
-
海水淡化的方法有多种,如蒸馏法、电渗析法等。电渗析法是一种利用离子交换膜进行离子交换的方法,其原理如图所示。己知海水中含Na+、Cl—、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。下列叙述中正确的是
A.B膜是阴离子交换膜
B.通电后,海水中阳离子往a电极处运动
C.通电后,a电极的电极反应式为:4OH--4e-=O2↑+2H2O
D.通电后,b电极上产生无色气体,溶液中出现少量白色沉淀
难度: 中等查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.常温下pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7
B.0.lmol/LNa2CO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.0.2mol/LNaA溶液和0.lmol/L盐酸溶液等体积混合所得碱性溶液中:
c(Na+)+c(H+)=c(A—)+c(Cl—)
D.pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等
难度: 困难查看答案及解析
-
将盐酸溶液逐滴滴入NaOH、NaAlO2、Na2CO3的混合溶液中,下列图像能正确表示溶液中反应的是
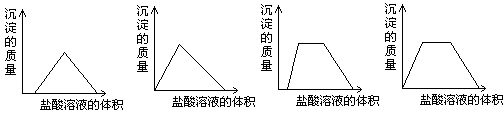
A B C D
难度: 中等查看答案及解析
