-
根据等电子原理判断,下列说法中错误的是
A.B3N3H6分子中所有原子均在同一平面上
B.B3N3H6分子中存在双键,可发生加成反应
C.H3O+和NH3是等电子体,均为三角锥形
D.CH4和NH4+是等电子体,均为正四面体
难度: 中等查看答案及解析
-
下列化学用语表达正确的是
A.原子核内有10个中子的氧原子:
B.氯原子的结构示意图:
C.Fe3+的最外层电子排布式为:
D.基态铜原子的外围电子排布图为:

难度: 中等查看答案及解析
-
已知某元素M原子的最外层电子排布式为nS1,下列说法正确的是
A.M一定是金属元素
B.M一定是S区元素
C.M的最高价是+1价
D.M可能呈现出 -1价
难度: 简单查看答案及解析
-
下列有关认识正确的是
A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n -1
D.各能层含有的电子数为2n2
难度: 中等查看答案及解析
-
已知1~18号元素的离子aW3+、bX2+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A.质子数c>d
B.氢化物的稳定性H2Y>HZ
C.离子半径X2+<W3+
D.第一电离能X>W
难度: 中等查看答案及解析
-
下列事实不能用分子间作用力解释的是
A.HF、H2O的沸点比HCl、H2S的沸点高很多
B.正戊烷的沸点比新戊烷的沸点高
C.邻羟基苯甲酸的沸点比对羟基苯甲酸的低
D.Na2O的熔点比MgO的熔点低
难度: 中等查看答案及解析
-
用萃取法从碘水中分离碘,所用萃取剂应具有的性质是
①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂
A.①②⑤ B.②③④C.①③⑤ D.①③④
难度: 中等查看答案及解析
-
下列说法正确的是
A.5.6g铁粉与硝酸反应失去电子数一定为0.3×6.02×1023
B.反应MgCl2(s)===Mg(s)+Cl2(g)的ΔH<0、ΔS>0
C.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
D.0.1mol·L-1Na2SO3溶液中:c(OH-)-c(H+)=2c(H2SO3)+c(HSO)
难度: 中等查看答案及解析
-
下图中两分子的关系是
A.互为同分异构体 B.是同一种物质
C.是手性分子 D.互为同系物
难度: 中等查看答案及解析
-
同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,下列说法正确的是
A.含有相同数目的中子、原子和分子
B.含有相同的分子数和电子数
C.含有相同的质子数和中子数
D.所含分子数和质量均不相同
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的是
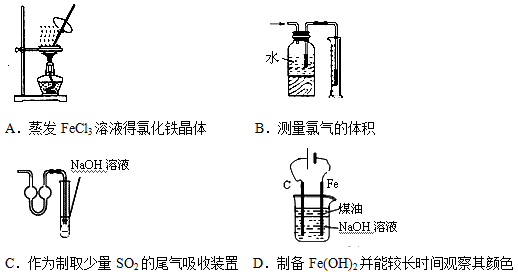
难度: 中等查看答案及解析
-
在以下的分子或离子中,VSEPR模型名称与该粒子的立体构型名称一致的是
A.NF3 B.CH C.SO3 D.H3O+
难度: 中等查看答案及解析
-
关于原子轨道的说法正确的是
A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.乙炔分子中,两个碳原子均采用sp2杂化轨道成键
D.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相等的新轨道
难度: 中等查看答案及解析
-
NH3和BF3可以通过配位键形成化合物NH3·BF3。下列说法正确的是
A.NH3、BF3两分子都是极性分子
B.NH3、BF3两分子的中心原子采取的都是sp3杂化
C.形成配合物时NH3中N原子提供的是孤对电子,BF3中B原子提供空轨道
D.形成配合物时BF3中B原子提供的是孤对电子,NH3中N原子提供空轨道
难度: 中等查看答案及解析
-
根据如图回答,下列说法不正确的是
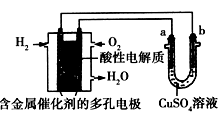 A.此装置用于铁表面镀铜时,a为铁
A.此装置用于铁表面镀铜时,a为铁B.此装置用于电镀铜时,硫酸铜溶液的浓度不变
C.燃料电池中正极反应为O2+2e-+2H+== H2O
D.若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
难度: 中等查看答案及解析
-
某温度下,在2 L的密闭容器中,加入1 mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)
3Z(g)。平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1∶1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
难度: 中等查看答案及解析
-
常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
难度: 中等查看答案及解析


