-
NA表示阿伏加德罗常数的值,下列说法中正确的是
A.含0.1 mol BaCl2的溶液中Cl-数为0.1NA
B.22 g CO2所含有的分子数为0.5NA
C.11.2 L CO2所含有的分子数为0.5NA
D.常温下NA个Cl2分子所占有的体积为22.4 L
难度: 简单查看答案及解析
-
下列物质中,只含离子键的是( )
A.O2 B.KOH C.MgO D.CO2
难度: 中等查看答案及解析
-
能大量共存于同一溶液中的离子组是( )
A.Ba2+、K+、SO42— B.Ca2+、NO3—、Cl—
C.Na+、Mg2+、OH— D.H+、Cl—、HCO3—
难度: 中等查看答案及解析
-
下列反应离子方程式书写不正确的是( )
A.硝酸银与氯化钾溶液的反应:Ag+ + Cl— == AgCl↓
B.硝酸与氢氧化钠溶液的反应:H+ + OH— == H2O
C.碳酸钙与盐酸的反应:CO32— + 2H+ == CO2↑+ H2O
D.锌粒与稀硫酸的反应:Zn + 2H+ ==Zn2+ + H2↑
难度: 中等查看答案及解析
-
下列各项实验操作中,正确的是
A. 实验剩余的药品不应放回原试剂瓶,但可以随意扔到垃圾筒中
B. 蒸发氯化钠溶液时不能用玻璃棒搅拌
C. 为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体
D. 若容量瓶漏水,可在玻璃塞上涂抹凡士林
难度: 简单查看答案及解析
-
下列不属于氧化还原反应的是
A. S + O 2
SO 2
B. Fe(OH)3 + 3HCl ==
FeCl3 + 3H2O
C. 2Mg + CO2
2MgO + C
D. 4HNO3(浓)
4NO2↑+ O2↑+ 2H2O
难度: 简单查看答案及解析
-
关于右图所示原电池装置中,叙述正确的是( )
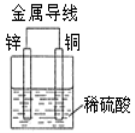
A.铜片上有气泡
B.铜片为负极
C.电流从锌片经导线流向铜片
D.该装置将电能转化为化学能
难度: 中等查看答案及解析
-
化学反应常伴有颜色变化,下列实验现象描述不正确的是
A. 将足量乙烯通入酸性高锰酸钾溶液中,紫色溶液逐渐褪色
B. 往氯化铁溶液中滴加氢氧化钠溶液,产生白色沉淀
C. 将足量二氧化硫通入品红溶液中,红色溶液逐渐褪色
D. 往葡萄糖溶液中加入新制氢氧化铜悬浊液并加热,产生砖红色沉淀
难度: 中等查看答案及解析
-
如图是常见四种有机物的比例模型示意图。下列说法正确的是
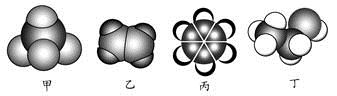
A. 甲能使酸性高锰酸钾溶液褪色
B. 乙可与溴水发生取代反应使溴水褪色
C. 丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键
D. 丁在稀硫酸作用下可与乙酸发生取代反应
难度: 中等查看答案及解析
-
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应:A
(g)+B(g)
C(g)+D(g)已达平衡的是
A. 混合气体的压强 B. 混合气体的密度
C. B的物质的量浓度 D. v(A)正= v(D)正
难度: 中等查看答案及解析