-
下列变化需要加入氧化剂才能实现的是
A. S2-→HS- B. HCO3-→CO2 C. I-→I2 D. Cu2+→Cu
难度: 中等查看答案及解析
-
下列四组物质中,前者属于电解质,后者属于非电解质的是
A. 二氧化碳 碳酸钠 B. 硫酸钠 乙醇
C. 氧化铝 硫 D. 盐酸 蔗糖
难度: 简单查看答案及解析
-
反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为
A. v(O2)=0.01mol/(L·s) B. v(NO)=0.08mol/(L·s)
C. v(H2O)=0.003mol/(L·s) D. v(NH3)=0.001mol/(L·s)
难度: 简单查看答案及解析
-
下列叙述正确的有几项( )
①NH3溶于水能导电,所以NH3是电解质
②BaSO4投入水中,导电性较弱,故它是弱电解质
③氯化氢水溶液能导电,所以氯化氢是电解质
④氯化钠溶液能导电,所以氯化钠溶液是电解质
⑤硫磺(S)不能导电,所以硫磺是非电解质
⑥CaCO3投入水中几乎不能导电,但CaCO3是强电解质.
A. 1项 B. 2项 C. 3项 D. 4项
难度: 中等查看答案及解析
-
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是( )
A. CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B. O2(g)+4H+(aq)+4e-=2H2O(1)
C. CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e–
D. O2(g)+2H2O(1)+4e–=4OH
难度: 中等查看答案及解析
-
在一定条件下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是10-amol/L和10-bmol/L,在此温度下,下列说法正确的是
A.a<b B.Kw=1.0×10-(7+ a) C.a=b D.Kw=1.0×10-(b+ a)
难度: 中等查看答案及解析
-
下列化学反应需要加快化学反应速率的是
A. 钢铁的腐蚀 B. 食物的腐烂
C. 工业炼钢 D. 塑料老化
难度: 简单查看答案及解析
-
两份等质量且足量的锌粉a和b,分别加入等量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示相同条件下其产生氢气的总体积(V)与时间的关系正确的是( )
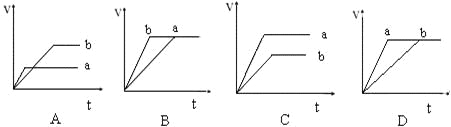
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在密闭容器中充入4molSO2和3molO2,一定条件下建立平衡:2SO2(g)+O2(g)
2SO3(g)ΔH=-QkJ/mol,测得SO2的转化率为90%,则反应放出的热量为( )
A.2QkJ B.1.8QkJ C.QkJ D.0.9QkJ
难度: 中等查看答案及解析
-
在2L的密闭容器中,发生以下反应:2A(g)+ B(g)
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
难度: 中等查看答案及解析
-
利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,正确的是
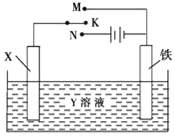
A. 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
B. 若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
C. 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D. 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小
难度: 困难查看答案及解析
-
下列依据热化学方程式得出的结论正确的是 ( )
A. 已知2SO2(g)+O2
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)=C(金刚石,s) △H﹥0,则金刚石比石墨稳定
C. 已知H+(aq)+OH–(aq)=H2O(1) △H = -57.3kJ·mol-1,则任何酸碱中和的反应热均为57.3 kJ
D. 已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2;则△H1﹤△H2
难度: 中等查看答案及解析
-
用酸性氢氧燃料电池为电源进行电解的实验装置如图所示,下列说法正确的是( )
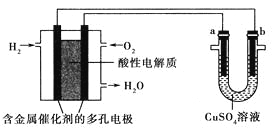
A. 燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B. 电解精炼铜时,若转移1mol电子,a极质量减少32g
C. 铁表面镀铜时,a为铁,b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
D. 若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的O2体积相同
难度: 困难查看答案及解析
-
将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=3 mol·L-1·min-1;
乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)= 1 mol·L-1·min-1。
则三个容器中合成氨的反应速率( )
A. v(甲)>v(乙)>v(丙) B. v(乙)>v(丙)>v(甲)
C. v(丙)>v(甲)>v(乙) D. v(乙)>v(甲)>v(丙)
难度: 中等查看答案及解析
-
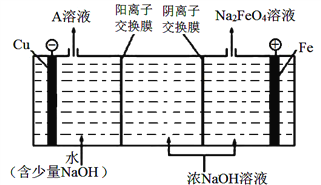
KIO3是食用碘盐的添加剂,工业上制取KIO3的方法之一如图所示,其中阳(阴)离子隔膜只允许阳(阴)离子通过,下列有关说法中正确的是( )
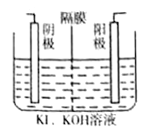
A. 可用铁作阳极、石墨作阴极
B. 装置中的隔膜为阳离子隔膜
C. 当外电路中通过2 mole-时,阴极上会有22.4LH2生成
D. 阳极电极反应式为:I--6e-+6OH-=IO3-+3H2O
难度: 困难查看答案及解析
-
下列各图中,表示吸热反应的图是( )
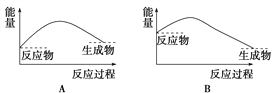
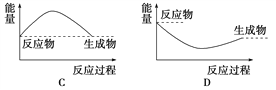
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关化学反应速率的说法中,正确的是
A. 2mol/L盐酸与锌反应时,加入4mol/L的氯化钠溶液,生成氢气的速率加快
B. 对于可逆反应2CO+2NO
N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快
C. 工业上合成氨是放热反应,升高温度,正反应速率减慢
D. 在K2SO4和BaCl2两溶液反应时,增大压强,生成沉淀速率加快
难度: 中等查看答案及解析
-
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )
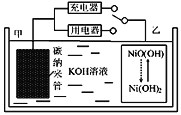
A. 放电时,甲电极反应为:NiO(OH)+H2O+e‾=Ni(OH)2+OH‾
B. 放电时,甲电极为正极,OH‾移向乙电极
C. 电池总反应为H2+2NiO(OH)
2Ni(OH)2
D. 充电时,电池的碳电极与直流电源的正极相连
难度: 困难查看答案及解析
-
一定条件下,CO2(g)+3H2(g)
H2O(g)+CH3OH(g) △H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是
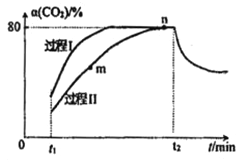
A. m点:v(正)>v(逆)
B. 活化能:过程Ⅱ>过程I
C. n点时该反应的平衡常数K=50
D. 过程I,t2时刻改变的反应条件可能是升高温度
难度: 困难查看答案及解析
-
如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的 ( )
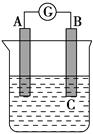
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Cu,B是Fe,C为稀Cu(NO3)2溶液
D. A是Fe,B是Ag,C为稀AgNO3溶液
难度: 简单查看答案及解析
-
下列应用与水解原理无关的是( )
A. 实验室盛放碳酸钠溶液的试剂瓶不能用玻璃塞
B. 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将两者混合就可产生大量二氧化碳的泡沫
C. 用氯化铵溶液除去铁锈
D. 可用碳酸钠与醋酸制取少量二氧化碳
难度: 中等查看答案及解析
-
电解质溶液的电导率越大,导电能力越强。用0.100 mol·L-1的NaOH溶液滴定10.00 mL浓度均为0.100 mol·L-1 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )

A. 曲线①代表滴定HCl溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A
D. D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
难度: 困难查看答案及解析
-
无色透明溶液中能大量共存的离子组是
A. Na+、Al3+、HCO3-、NO3- B. AlO2-、Cl-、Mg2+、K+
C. NH4+、Na+、CH3COO-、NO3- D. Na+、NO3-、ClO-、I-
难度: 中等查看答案及解析
-
H2和I2在一定条件下能发生反应:H2(g)+I2(g)
2HI(g),1molH2完全反应放出akJ热量。
已知:
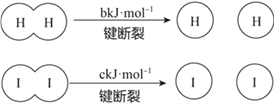 (a、b、c均大于零)
(a、b、c均大于零)下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1molH-H键和1molI-I键所需能量大于断开2molH-I键所需能量
C. 断开2molH-I键所需能量约为(c+b+a)kJ
D. 向密闭容器中加入2molH2和2molI2,充分反应放出的热量大小2akJ
难度: 中等查看答案及解析
-
—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g)
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
容器
温度/K
物质的起始浓度(mol/L)
物质的平衡浓度(mol/L)
CO2(g)
H2(g)
C2H5OH(g)
H2O(g)
C2H5OH(g)
甲
500
0.20
0.60
0
0
0.083
乙
500
0.40
1.20
0
0
丙
600
0
0
0.10
0.30
0.039
A. 该反应正反应为吸热反应
B. 达平衡时,甲、乙容器内:2c(CO2,甲)<c(CO2,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
难度: 中等查看答案及解析
-
—定条件下,在容积为10L的密闭容器中,将2molX和1molY进行如下反应:2X(g)+Y(g)
Z(s),经1min达到平衡生成0.3mol的Z,下列说法正确的是
A. 1min内,用Z表示平均反应速率为0.03mol·L-1·min-1
B. 将容器容积变为20L,Z的新平衡浓度将等于原平衡浓度的一半
C. 当X的体积分数不变时,则说明该反应达到平衡状态
D. 若温度和体积不变,往容器内增加1molX,Y的转化率将增大
难度: 困难查看答案及解析
-
某溶液中有Mg2+、Fe2+、Fe3+和Al3+四种阳离子,若向其中加入过量的NaOH溶液,微热并搅拌,过滤,在滤渣中再加入过量的盐酸,所得溶液中大量增加的阳离子是( )
A. Mg2+ B. Fe2+ C. Fe3+ D. Al3+
难度: 中等查看答案及解析
-
已知:常温下,0.01 mol/L MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A. -69.4 kJ·mol-1 B. -45.2 kJ·mol-1
C. +69.4 kJ·mol-1 D. +45.2 kJ·mol-1
难度: 中等查看答案及解析
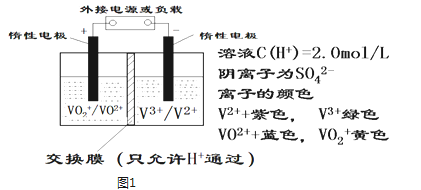
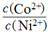 的值等于_____。
的值等于_____。