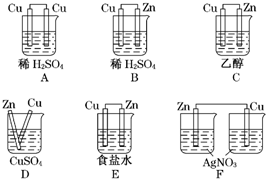
-
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.CCl4的电子式:
B.Cl-的结构示意图
C.CO2的电子式
D.质量数为37的氯原子3717Cl难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.周期表是按原子量逐渐增大的顺序从左到右排列的
B.最外层电子数相同的元素都是同一族
C.同族元素的最外层电子数一定相同
D.同周期元素的电子层数相同难度: 中等查看答案及解析
-
下列各组微粒,按半径由大到小顺序排列的是( )
A.Mg、Ca、K、Na
B.S2-、Cl-、K+、Na+
C.Br-、Br、Cl、S
D.Na+、Al3+、Cl-、F-难度: 中等查看答案及解析
-
下列关于气态氢化物的叙述正确的是( )
A.只有非金属元素才能形成气态氢化物
B.气态氢化物的水溶液都是酸
C.同周期从左到右非金属元素的气态氢化物的稳定性减弱
D.卤族元素从上到下气态氢化物的稳定性增强难度: 中等查看答案及解析
-
下列离子中,所带电荷数与该离子的核外电子层数相等的是( )
A.Mg2+
B.Al3+
C.Be2+
D.H+难度: 中等查看答案及解析
-
某元素X的最高价含氧酸的化学式为HnXO2n-2,在气态氢化物中,X元素的化合价为( )
A.5n-12
B.3n-12
C.3n-6
D.n-10难度: 中等查看答案及解析
-
U是重要的核工业原料,在自然界的丰度很低.
U的浓缩一直为国际社会关注.下列有关
U说法正确的是( )
A.U原子核中含有92个中子
B.U原子核外有143个电子
C.U与
U互为同位素
D.U与
U互为同素异形体
难度: 中等查看答案及解析
-
对相同状况下的12C18O和14N2两种气体,下列说法正确的是( )
A.若质量相等,则质子数相等
B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等
D.若体积相等,则密度相等难度: 中等查看答案及解析
-
对Na、Mg、Al的有关性质的叙述正确的是( )
A.碱性:NaOH>Mg(OH)2>Al(OH)3
B.原子半径:Na<Mg<Al
C.离子半径:Na+<Mg2+<Al3+
D.单质的还原性:Al>Mg>Na难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是( )
A.铝片与稀盐酸的反应
B.灼热的炭与CO2的反应
C.Ba(OH)2•8H2O与NH4Cl的反应
D.甲烷在氧气中的燃烧反应难度: 中等查看答案及解析
-
在新研制的超导材料中,铊(Tl)是主要组成元素之一.已知铊为ⅢA族原子序数最大的金属元素,则下列关于铊元素性质的推测,不正确的是( )
A.是银白色较软的金属
B.Tl(OH)3与Al(OH)3相似,也是两性氢氧化物
C.可以形成氧化物Tl2O3
D.与酸反应比铝剧烈难度: 中等查看答案及解析
-
一定温度下,在密闭容器内进行着某一反应,X气体(2mol)、Y气体(10mol)的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
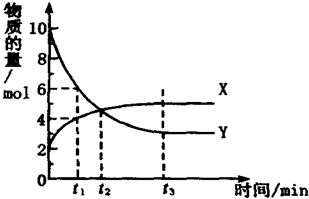
A.反应的化学方程式为5Y⇌X
B.t1时,Y的浓度是X浓度的1.5倍
C.t2时,正、逆反应速率相等
D.t3时,逆反应速率大于正反应速率难度: 中等查看答案及解析
-
进行如下实验,在A锥形瓶中放入10g绿豆大小的碳酸钙,在B锥形瓶中放入5g粉末状的碳酸钙,分别加入50mL 1mol/L盐酸,下图中能正确表示实验结果的是(注:x一时间、y-锥形瓶中碳酸钙减少的质量)( )
A.
B.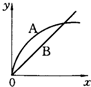
C.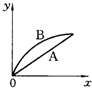
D.
难度: 中等查看答案及解析
-
可逆反应2HI(g)⇌H2(g)+I2(g)在密闭容器中进行,当下列4项中某项不随时间变化时,才能说明反应已达平衡( )
A.容器内压强
B.平均相对分子质量
C.混合气密度
D.混合气体颜色难度: 中等查看答案及解析
-
把3mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+B(g)
xC(g)+2D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/,下列结论错误的是( )
A.A的平均反应速率为0.15mol/
B.平衡时,C的浓度为0.25mol/L
C.平衡时,B的转化率为20%
D.平衡时,容器内压强为原来的0.8倍难度: 中等查看答案及解析
-
下列分子含有的电子数目与HF相同,且只有两个极性共价键的是( )
A.CO2
B.N2O
C.H2O
D.CH4难度: 中等查看答案及解析