-
下列生活用品的主要成分是蛋白质的是
A. 羽绒被 B. 有机玻璃 C. 面巾纸 D. 涤纶布
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 0.1 mol • L-1pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
B. 常温下,PH=2的CH3COOH溶液和H2SO4溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离出的c(H+)不相等
C. 常温下将浓度为0.1 mol·L-1的HF溶液加水不断稀释,溶液中c(H+)/c(HF)的值始终保持增大
D. 常温下0.1 mol·L-1的下列溶液①NH4Fe(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中:c(NH4+)由大到小的顺序是:②>①>④>③
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 10g质量分数为46%的乙醇溶液中,氢原子的总数约为1.2NA
B. 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA
C. 1L pH=13的NaOH溶液中含有OH-的数目一定为0.1 NA
D. 0.1molO2完全反应时,转移的电子数为0.4NA
难度: 中等查看答案及解析
-
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是
A. pH=1的无色溶液中:Na+、Cu2+、Cl-、
B. 使酚酞呈红色的溶液中:K+、Na+、NO3-、Cl-
C. 0.1 mol·L-1的FeCl2溶液中:H+、Al3+、SO42-、S2-
D. 由水电离出的c(H+)=1×10-10 mol·L-1的溶液中:Mg2+、NH4+、SO42-、HCO3-
难度: 中等查看答案及解析
-
根据原子结构及元素周期律的知识,下列叙述正确的是
A. 由于相对分子质量:HCl>HF,故沸点:HCl>HF
B. 硅处于金属与非金属的过渡位置,硅可用作半导体材料
C. 由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在
D. Cl-、S2-、Ca2+、K+半径逐渐减小
难度: 困难查看答案及解析
-
随着各地治霾力度的加大,大力发展高性能燃料电池汽车成为研究课题。如图是某课题组设计的液体燃料电池示意图。下列有关叙述不正确的是

A. 该电池的优点是不产生污染气体,且液体燃料便于携带
B. 电池内部使用的是阴离子交换膜,OH-经交换膜移向负极
C. 该燃料电池的电极材料采用多孔纳米碳材料(如图),目的是增大接触面积,增加吸附量
D. 该电池中通入N2H4的电极为正极,发生的电极反应式为N2H4+4OH--4e-=N2↑+4H2O
难度: 困难查看答案及解析
-
某学习兴趣小组讨论辨析以下说法,其中说法正确的是
①通过化学变化可以实现16O与18O间的相互转化
②煤的气化与液化都是物理变化
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物
A. ③⑤⑥ B. ①② C. ③⑤ D. ①③④
难度: 中等查看答案及解析
-
右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是
X
Y
Z
W
T
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 向苯酚钠溶液中通入少量CO2:2C6H5O
+CO2+H2O→2C6H5OH+CO32-
B. NH4HSO3溶液与足量NaOH溶液反应:HSO
+OH-=SO32-+H2O
C. Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+=Fe2++2H2O
D. H218O2中加入H2SO4酸化的KMnO4:5H218O2+2MnO
+6H+= 518O2+2Mn2++8H2O
难度: 困难查看答案及解析
-
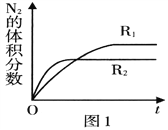
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)
CO(g)+3H2(g),设起始
=Z,在恒压下,平衡时
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
A. 该反应的焓变△H<0
B. 图中Z的大小为b<3<a
C. 图中X点对应的平衡混合物中
=3
D. 温度不变时,图中X点对应的平衡在加压后
(CH4)增大
难度: 中等查看答案及解析
-
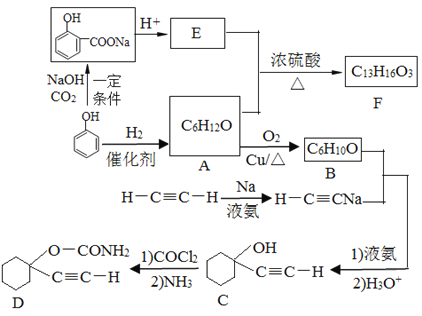
A是中学化学中常见的单质,B、C为化合物。它们有如图所示的转化关系(部分产物及反应条件省略)。下列判断正确的是
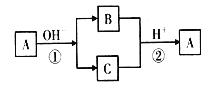
A. A可能是金属,也可能是非金属
B. A、B、C不一定含有同一种元素
C. B、C的水溶液可能都呈碱性
D. A的氧化物的水化物为强酸
难度: 中等查看答案及解析
-
工业上可利用右图所示电解装置吸收和转化SO2 (A,B均为惰性电极)。下列说法正确的是

A. B电极为电解池的阴极
B. B极区吸收5mo1 SO2,则A极区生成2.5 mo1 S2O42-
C. B极区电解液为稀硫酸,电解一段时间后硫酸浓度增大
D. A电极的电极反应为:2SO32--2e-+4H+=S2O42- + 2H2O
难度: 困难查看答案及解析
-
下列实验操作和现象及所得出的结论均表述正确的是 ( )
选项
实验操作和现象
结论
A
向装有Fe(NO3)2溶液的试管中加入稀硫酸,在管口观察到红棕色气体
HNO3分解生成了NO2
B
向淀粉溶液中加入稀硫酸,加热几分钟,冷却后再加入新制氢氧化铜悬浊液,加热,没有砖红色沉淀生成
淀粉没有水解生成葡萄糖
C
向饱和Na2CO3溶液中通入足量CO2,溶液变混浊
析出了NaHCO3
D
向无水乙醇中加入浓硫酸,加热至170℃,产生的气体通入酸性高锰酸钾溶液,溶液红色褪去
使酸性高锰酸钾溶液褪色的气体只有乙烯
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
将m g镁铝合金投入到500 ml 2 mol/L的盐酸中,固体完全溶解,收集到气体5.6L (标准状况下)。向反应所得溶液中加入4mol/L的氢氧化钠溶液,沉淀达到最大值为13.60 g,则m的值为
A. 11.48 B. 9.35 C. 8.50 D. 5.10
难度: 中等查看答案及解析
-
体积为1 mL、浓度均为0.10 mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是
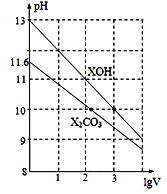
A. XOH是弱碱
B. pH=10的两种溶液中的c(X+):XOH大于X2CO3
C. 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D. 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32-)减小
难度: 极难查看答案及解析