-
下列实验“操作和现象”与“结论”对应关系正确的是
操作和现象
结论
A
向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体
HNO3分解生成了NO2
B
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成
淀粉没有水解成葡萄糖
C
向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去
使溶液褪色的气体只是乙烯
D
向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊
析出了NaHCO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
美国《时代杂志》选出了十大最具抗氧化能力的食物,其中最好的是番茄,这是因为番茄中含有丰富的茄红素。下列有关说法中正确的是
A. 茄红素具有较强的氧化性
B. 茄红素在抗氧化过程中某元素的化合价升高
C. 茄红素在抗氧化过程中得到电子
D. 茄红素在抗氧化过程中某元素发生还原反应
难度: 中等查看答案及解析
-
明代宋应星著的《天工开物》中有关于“火法”冶炼锌的工艺记载:“炉甘石十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”下列说法不正确的是(注:炉甘石的主要成分为碳酸锌)
A. 倭铅是指金属锌和铅的混合物
B. 该冶炼锌的反应属于置换反应
C. 冶炼Zn的反应方程式为:ZnCO3+2C
Zn+3CO↑
D. 煤炭中起作用的主要成分是C
难度: 中等查看答案及解析
-
化学与人类生产、生活密切相关,下列有关说法不正确的是
A. 血糖过低的患者可利用静脉注射葡萄糖溶液的方法迅速补充营养
B. 固体很难被压缩是因为其内部的分子之间存在斥力作用
C. 用活性炭为糖浆脱色和用 SO2漂白纸浆的原理不同
D. 海水淡化的方法有蒸馏法、电渗析法等
难度: 中等查看答案及解析
-
对下列各组物质的分类正确的是
①混合物:水玻璃、水银、水煤气
②电解质:明矾、冰醋酸、石膏
③酸性氧化物:CO2、Al2O3、SO3
④同位素:1H、2H2、3H
⑤同素异形体: C60、金刚石、石墨
⑥干冰、液氯等都是非电解质
A. ①②③④⑤⑥ B. ④⑥ C. ②⑤⑥ D. ②⑤
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 46g C2H6O中共用电子对数为4NA
B. 7.8g Na2O2中含有的阴离子数为0.2NA
C. 100mL 2.0mol/L NH4HCO3溶液中NH4+数为0.2NA
D. 标准状况下,22.4L NO与CO的混合气体中含有的原子数为2NA
难度: 困难查看答案及解析
-
已知16S和34Se位于同一主族,下列说法正确的是
A. 热稳定性:H2Se>H2S>H2O B. 原子半径:Se>S>Cl
C. 酸性:H2SeO4>H2SO4>HClO4 D. 还原性:S2->Se2->Br-
难度: 中等查看答案及解析
-
下列离子方程式错误的是( )
A. 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO
===BaSO4↓+2H2O
B. 酸性介质中KMnO4氧化H2O2:2MnO
+5H2O2+6H+===2Mn2++5O2↑+8H2O
C. 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-===Mg(OH)2↓
D. 铅酸蓄电池充电时的阳极反应:PbSO4+2H2O-2e-===PbO2+4H++SO
难度: 中等查看答案及解析
-
下列各组粒子能在指定溶液中大量共存的是
A. 银氨溶液中:Na+、H+、NO3- B. 碘化钾溶液中:H+、H2O2、SO32-
C. 氢氧化钙溶液中:Na+、ClO-、HCO3- D. 偏铝酸钠溶液中:K+、Cl-、SO42-
难度: 中等查看答案及解析
-
已知Ca(OH)2的溶解度随温度的升高而降低,将40℃的饱和澄清石灰水冷却至l0℃,或保持40℃向其中加入少量CaO,两种情况下均保持不变的是
A. 溶液中Ca2+的数目 B. 溶剂的质量
C. 溶液中溶质的物质的量浓度 D. 溶质的质量
难度: 中等查看答案及解析
-
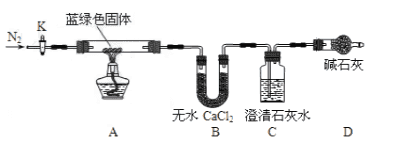
用下列装置完成相关实验,不合理的是

A. 用a制备并收集氨气 B. 用b制备并检验乙炔
C. 用c蒸馏海水得到淡水 D. 用d分离Na2CO3溶液与CH3COOC2H5
难度: 中等查看答案及解析
-
在一个密闭容器中盛有 11g X 气体(X 的摩尔质量为 44g·mol-1)时,压强为 1×104Pa。如果在相同 温度下,把更多的气体 X 充入容器,使容器内的压强增至 5×104Pa,这时容器内气体 X 的分子数约为( )
A. 3.3×1025 B. 3.3×1024 C. 7.5×1023 D. 7.5×1022
难度: 中等查看答案及解析
-
一定量的金属Cu完全溶于适量浓硝酸中,收集到混合气体(含NO、N2O4、NO2)共1.8 mol。将上述气体平均分为两份,一份与标准状况下8.96LO2混合后,用水吸收,无气体剩余;另一份恰好能被500mL 2mol/L NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,则其中NaNO3的物质的量为
A. 0.1mol B. 0.15mol C. 0.2mol D. 0.25mol
难度: 困难查看答案及解析
-
KHSO4、BaCl2、Na2CO3、FeSO4和氯水五种溶液,如图所示的相互反应,图中每条连线两端的物质可以发生化学反应.下列说法不合理的是( )

A. X一定为KHSO4 B. Y一定为Na2CO3
C. Z可能是氯水 D. M、N必定各为BaCl2、FeSO4中的一种
难度: 中等查看答案及解析
-
一种碳钠米管能够吸附氢气可作二次电池(如下图所示)的碳电极。该电池的电解质溶液为6mol/L的KOH溶液,下列说法正确的是
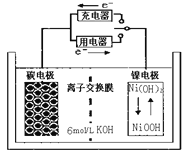
A. 充电时阴极发生氧化反应
B. 充电时将碳电极与电源的正极相连
C. 放电时碳电极反应为:H2-2e-=2H+
D. 放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
A. 元素W的最高价氧化物对应水化物的酸性比Q的强
B. 原子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)> r(Z3+)
C. 元素X与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
难度: 中等查看答案及解析
-
将KCl和CrCl3两种固体混合物共熔,得化合物X。X由K、Cr、Cl三种元素组成。将1.892gX中的Cr全部氧化成Cr2O72-,Cr2O72-可从过量的KI溶液中氧化出2.667g碘单质(Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O)。向溶有1.892gX的溶液中加入过量的AgNO3溶液,可得4.52gAgCl沉淀。则表示X的化学式为
A. K3Cr2Cl9 B. K3Cr2Cl5 C. K3Cr2Cl7 D. K2CrCl4
难度: 困难查看答案及解析
-
向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的
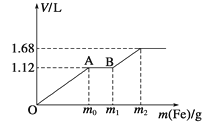
A. 开始时产生的气体为H2
B. AB段产生的反应为置换反应
C. 所用混合溶液中c(HNO3)=0.5mol·L-1
D. 参加反应铁粉的总质量m2=5.6 g
难度: 中等查看答案及解析
-
有一澄清透明的溶液,只可能含有大量的Fe3+ 、 Fe2+ 、H+、AlO2-、Al3+ 、CO32- 、NO3-七种离子中的几种,向该溶液中逐滴加入一定量1 mol·L-1 NaOH溶液的过程中,开始没有沉淀,而后才有沉淀。则下列 判断正确的是
A. 溶液中可能含有AlO2-
B. 溶液中可能含有Fe3+ ,但一定不含Fe2+
C. 溶液中一定不含Fe2+和Fe3+
D. 溶液中可能含有NO3-
难度: 中等查看答案及解析
-
某工厂废水中含有5.00×10-3mol/L的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5 Fe1.5FeO4的流程图示意如下:

下列有关判断错误的是
A. 操作①中反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
B. 操作②所得的滤渣成分主要为Fe(OH)3、Fe(OH)2、Cr(OH)3
C. 磁性材料Cr0.5Fe1.5FeO4中,显+3价铁与显+2价铁的质量之比为2∶3
D. 若废水中杂质不与绿矾反应,将该1 L废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需加入绿矾13.9 g
难度: 中等查看答案及解析